选项 | a | b | 气体 | 装置 |
A | 稀硝酸 | Cu | NO |
|
B | 稀硫酸 | 大理石 | CO2 | |
C | 浓氨水 | 生石灰 | NH3 | |
D | 浓硫酸 | Na2SO3 | SO2 |

选项 | 操作 | 现象 | 结论 |
A | 将NaAlO2溶液与NaHCO3溶液混合 | 产生白色絮状沉淀 | 结合质子能力:AlO |
B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
C | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 酸性 KMnO4溶液褪色 | 制得气体为乙烯 |
D | 向1mL0.1moL·L-1KCl溶液中加入过量AgNO3溶液,再加入1mL 0.1moL·L-1 KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
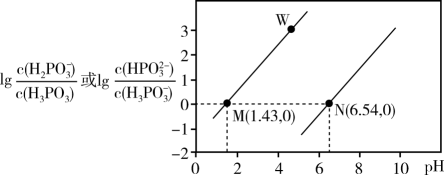

已知:①饱和NaClO2溶液中析出的晶体成分与温度的关系如下表所示:
温度/℃ | <38 | 38~60 | >60 |
晶体成分 | NaClO2·3H2O | NaClO2 | NaClO2分解成NaClO3和NaCl |
②ClO2极易溶于水,不与水反应,沸点11℃。

已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4CSrS+4CO↑
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
氢氧化锶 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
回答下列问题:
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为。

③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因。
已知:①C2H8N2(l)+4O2(g)=2CO2(g)+N2(g)+4H2O(l) ΔH1=-2765.0kJ/mol
②2O2(g) +N2(g)=N2O4(l) ΔH2=-19.5kJ/mol
③H2O(g)= H2O(l) ΔH3=-44.0kJ/mol
则C2H8N2(1)+2N2O4(1)=3N2(g)+2CO2(g)+4H2O(g)的ΔH为。
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____
①达到平衡后,仅升高温度,k正增大的倍数(填“大于”“小于”或“等于”)k逆增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和N2物质的量之比为2:2:1,压强为p0kPa。达平衡时压强为0.9p0kPa,则。
①3N2H4(1)=4NH3(g)+N2(g) ΔH1 Kp1
②4NH3(g)=2N2(g)+6H2(g) ΔH2 Kp2
绘制pKp1-T和pKp2-T的线性关系图如图所示:(已知:pKp=-1gKp)

①由图可知,ΔH10(填“>”或“<”)
②反应3N2H4(1)=3N2(g)+6H2(g)的K=(用Kp1、Kp2表示);该反应的ΔH0(填“>”或“<”),写出推理过程

①该单质的晶体类型为
②从图1中取出该物质的晶胞如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图2中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1),则原子3和原子4的坐标分别为、。

③根据图1中所给的数据,阿伏加德罗常数的值为NA , 石墨的密度为g/cm3。(列出计算式)
a.能发生银镜反应,遇FeCl3显紫色。
b.结构中存在-NO2。
c.核磁共振氢谱显示有4组峰,峰面积之比为1:2:2:2。
 的合成路线(无机试剂、反应条件试剂任选)。
的合成路线(无机试剂、反应条件试剂任选)。