A | B | C | D |
|
|
|
|
冬奥场馆使用CO2跨临界直接制冰(“水立方”场馆中的水冰转换) | 北京冬奥会菜单上有678道菜,其中工作人员对食材进行的煎、炒、烹、炸过程 | 冬奥会开幕式中火炬“飞扬”中氢燃料的燃烧 | 冬奥会上采用紫外杀菌技术使蛋白质变性 |
 C . 中子数为18的氯原子:
C . 中子数为18的氯原子:去除CO2中少量HCl | 制取氯气 | 分离酒精和水 | 收集NO2 |
|
|
|
|
A | B | C | D |
装置 | 序号 | 操作 | 现象 |
| ① | 将试管置于冰水浴中 | 溶液均呈粉红色 |
② | 加水稀释 | ||
③ | 加少量ZnCl2固体 |
以下结论和解释正确的是( )

选项 | 实验操作 | 实验目的或结论 |
A | 向2mL0.1mol·L-1MgCl2溶液中加入5mL0.1mol·L-1NaOH溶液,出现白色沉淀后,继续滴入几滴FeCl3浓溶液,静置,出现红褐色沉淀 | 相同温度下,Fe(OH)3比Mg(OH)2更难溶 |
B | 向某溶液中滴加少量KSCN溶液,无现象,再滴加几滴新制氯水,溶液变红 | 该溶液中含有Fe2+ |
C | 向BaCl2溶液中通入SO2和X气体,产生白色沉淀 | 气体X一定具有强氧化性 |
D | 室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液pH约为10,0.1mol·L-1NaHSO3溶液pH约为5 | HSO |

由CO2催化加氢合成甲醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3 , 它们随温度变化的曲线如图所示。
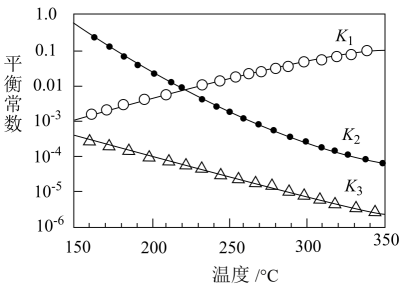
①则△H2△H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确的是(填字母)。
a.增大初始投料比 , 有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在(填“阴”或“阳”)极生成;
②氧化反应为。
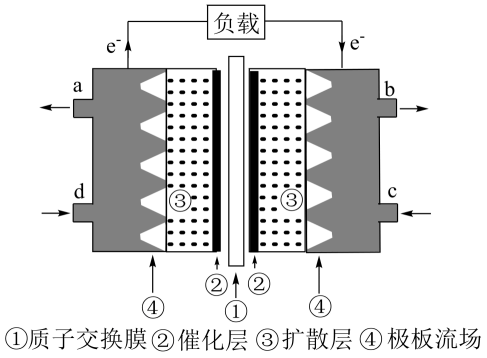
该电池工作时,c口通入的物质是。

尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②。
a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
氧化锆(化学式为ZrO2)晶胞结构如图所示,Zr4+在晶胞中的配位数是,若该晶胞的密度为ρg·cm-3 , 用NA表示阿伏加德罗常数的值,则该晶胞的体积是cm3(列出计算式)。(氧化锆的摩尔质量M=123g·mol-1)

元素 | 电离能(kJ·mol-1) | ||
I1 | I2 | I3 | |
Mn | 717 | 1509 | 3248 |
Fe | 759 | 1561 | 2957 |
①铁元素位于元素周期表族,属于区。
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因。

已知:ⅰ.R—NH2
R—NH2(R代表烃基)
ⅱ.—NH2易被氧化
回答下列问题:
 的作用。
的作用。
①含有—NO2的芳香族化合物
②能发生水解反应且水解产物之一含有醛基
③苯环上一氯代物有两种
资料1:金属离子沉淀的pH
Al(OH)3 | Cu(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | |
开始沉淀pH | 3.53 | 4.91 | 6.88 | 7.40 | 8.14 |
完全沉淀pH | 4.89 | 6.67 | 8.87 | 9.39 | 10.14 |
由数据分析,甲同学提出可以控制溶液pH至去除溶液中铜离子。
pH | 5 | 8 | 10 | 12 |
铜的沉淀率 | 2.3 | 7.2 | 9.8 | 12 |
由数据分析pH=12时铜的沉淀率为12%,远小于理论分析结果,分析可能原因。
结论:不可以通过调pH去除铜。
资料2:抗坏血酸(C6H8O6)具有较强的还原性,氧化后为脱氢抗坏血酸(C6H6O6);受热易分解。
向柠檬酸浸出液中加入抗坏血酸能有效的将Cu2+还原成金属Cu。某实验小组研究了相同条件下,pH、反应时间和温度分别对Cu沉淀率的影响。
依据图1和图2,判断沉淀铜选择最佳pH为,理由是。


结论:可以通过还原法去除铜。
查阅资料:Mn2+的稀溶液几乎无色,在酸性介质中,S2O能将Mn2+氧化成MnO
。
甲同学设计实验如表。
序号 | 实验操作 | 实验现象 |
Ⅰ | 向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体 | 5min无明显现象 |
序号 | 实验操作 | 实验现象 |
Ⅱ | 向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾 | 溶液变棕黄色,1min后出现紫红色 |
Ⅲ | 向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,再滴入2滴0.1mol·L-1AgNO3溶液 | 溶液变棕黄色,5min出现紫红色 |
Ⅳ | 向1mL0.05mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体,加热至沸腾 | 迅速生成棕黑色沉淀 |
①对比实验Ⅱ、Ⅲ,推测实验Ⅰ无明显现象的原因。
②解释实验Ⅱ、Ⅲ中溶液变棕黄色的原因。
③结合离子方程式解释实验Ⅳ中产生棕黑色沉淀的原因。
序号 | 实验操作 | 实验现象 |
V | 向1mL0.002mol·L-1MnSO4溶液中滴入3滴3mol·L-1H2SO4溶液并加入一粒米大的K2S2O8固体+,微热 | 1min后出现紫红色 |
完成表格中空白处。