选项 | 化学性质 | 实际应用 |
A | 乙烯能与KMnO4溶液反应 | 用浸泡过KMnO4溶液的硅土保存水果 |
B | SO2具有还原性 | 用SO2漂白纸浆和草帽 |
C | FeCl3具有氧化性 | 用FeCl3溶液刻蚀铜制印刷电路板 |
D | 长链烷烃裂解可得短链烷烃和烯烃 | 用重油裂解制备有机化工原料 |
 B .
B .  C .
C .  D .
D . 
选项 | 劳动项目 | 化学方程式 |
A | 家务劳动:巧用食醋除水垢 | 2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O |
B | 社区服务:学习用小苏打烘焙糕点 | NaHCO3+HCl=NaCl+H2O+CO2↑ |
C | 工厂参观:工业生产漂白粉 | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
D | 自主探究:用含铝粉和氢氧化钠的疏通剂疏通管道 | 2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ |


选项 | 实验内容 | 实验目的 |
A | 向两支盛有5 mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象 | 探究浓度对反应速率的影响 |
B | 向盛有1 mL 20%蔗糖溶液的试管中滴入3 ~ 5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入银氨溶液 | 检验蔗糖的水解产物中是否有葡萄糖 |
C | 向盛有2 g碳酸钠粉末的试管中加入少量水后,碳酸钠粉末结块变成晶体,用手触摸试管壁 | 验证碳酸钠粉末遇水生成碳酸钠晶体是放热反应 |
D | 向盛有5 mL 0.05 mol·L-1FeCl3溶液的试管中加入1 mL 0.15 mol·L-1 KSCN 溶液,溶液显红色,再加入1mol· L-1 KSCN溶液 | 验证 Fe3+和SCN-的反应为可逆反应 |


已知:氯气溶解过程发生如下反应:
①Cl2(aq)+H2O(l)H+(aq)+Cl-(ag)+HClO(aq)K1=4.2×10-4
②Cl2(aq)+Cl-(aq)Cl
(aq)K2=0.19
③HClO(aq)H+(aq)+ClO-(aq)Ka=3.2×10-8
下列说法正确的是( )
实验序号 | 实验操作 | 实验现象 |
1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
经检验反应产生的气体有H2 , 实验室检验H2的方法为。
|
实验序号 |
实验操作 |
|
2 |
分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
|
3 |
分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |
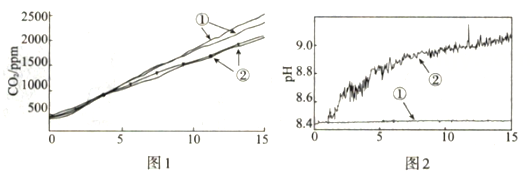
图1中曲线②对应的CO2含量逐渐增大的原因为 (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为。
小组成员推测可能是溶液中的Na+或HCO加快了该反应的发生,对比实验1设计实验如下:
|
实验序号 |
实验操作 |
实验现象 |
|
4 |
向 溶液中加入长3 cm的镁条 |
持续快速产生大量气泡,溶液略显浑浊 |
①实验4中横线处内容为。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO能加快该反应的原因为。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
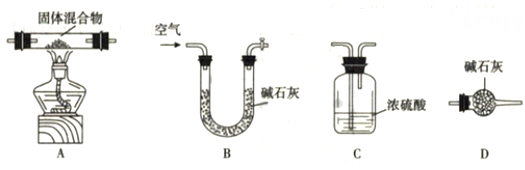
甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为(填字母编号)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
|
化合物 |
Cr(OH)3 |
Ca(OH)2 |
Mg(OH)2 |
SrCO3 |
|
Ksp近似值 |
1×10-31 |
5.5×10-6 |
1.8×10-11 |
5.6×10-10 |
回答下列问题:
I.![]() (g)
(g) ![]() (g) +H2O(g) ΔH1>0
(g) +H2O(g) ΔH1>0
II.![]() (g) +NH3(g)
(g) +NH3(g) ![]() +H2O(g)+
+H2O(g)+ ![]() (g) ΔH2>0
(g) ΔH2>0
化学键 | C-O | C-C | C=C | C-H | O-H | C=O |
键能(kJ·mol -1) | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算ΔH1 =。
 ×100%)。
×100%)。 
①随着温度的升高,![]() (g)的平衡体积分数先增大后减小的原因为。
(g)的平衡体积分数先增大后减小的原因为。
②科学家通过DFT计算得出反应II的机理如图2所示,其中第二步反应为![]() (g)
(g) ![]() (g)+H2O(g), 则第一步反应的化学方程式为 ;实验过程中未检测到
(g)+H2O(g), 则第一步反应的化学方程式为 ;实验过程中未检测到![]() (g)的原因可能为。
(g)的原因可能为。

③A点对应反应II的标准平衡常数= ( 保留两位有效数字)。[其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为kPa)除以p0(p0=100 kPa)]
④实际生产中若充入一定量N2 (不参与反应),可提高丙烯腈的平衡产率,原因为。

通电过程中,石墨电极2上的电极反应式为。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
 )分别以任意比互溶。
)分别以任意比互溶。 ①二甲基亚砜分子中硫原子的杂化类型为 。
②丙酮分子中各原子电负性由大到小的顺序为。
③沸点:二甲基亚砜 丙酮(填“>”或“<”),原因为 。
④二甲基亚砜能够与水以任意比互溶的原因为 。
 , 该配合物中心原子Cr的价层电子数为 。[已知:配合物二茂铁(
, 该配合物中心原子Cr的价层电子数为 。[已知:配合物二茂铁(①该晶体中锰原子的配位数为 ;
②已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为(列出计算式即可)。

 。
。