
|
选项 |
A |
B |
C |
D |
|
实验设计 |
|
|
|
|
|
实验目的 |
探究影响物质溶解性的因素 |
比较铁、铜、银三种金属活动性强弱 |
探究铁生锈的条件 |
比较吸入空气和呼出气体中二氧化碳的多少 |

①计算:市售 H2O2溶液溶质质量分数通常为 30 %。配制 500 g 6 %的 H2O2溶液,需要30 %的 H2O2溶液质量为g。
②配制:量取所需 H2O2溶液和水于烧杯中,用玻璃棒搅拌,充分混合。
③装瓶:把配制好的 H2O2稀溶液装入试剂瓶中,贴上标签。在下图标签中填上相应的内容。
![]()

①可选择的发生装置为(填序号)。
②可用 C 装置收集 O2的理由是。


资料卡片:铁与硫酸铁溶液反应的化学方程式为。
|
温度/℃ |
0 |
10 |
30 |
40 |
50 |
60 |
64 |
70 |
80 |
90 |
|
溶解度/g |
15.6 |
20.5 |
33.0 |
40.4 |
48.8 |
55.0 |
55.3 |
50.6 |
43.7 |
|
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||
【查阅资料】
①铝碳酸镁片主要成分化学式为[Al2Mg6(OH)16CO3·4H2O],含有 Al3+、Mg2+、OH-和。
③抗酸原理:药物中的部分离子和胃酸中的 H+反应,降低胃液酸性。
④药物使用说明书,如图1。

【提出问题】①哪种药剂治疗胃酸过多引起胃疼的效果好?
②每片药剂中碳酸氢钠的含量是多少?
实验一 比较两种药剂的治疗效果
【设计实验】
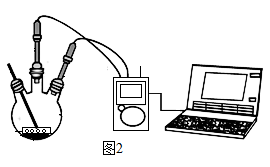
小组同学各取 1.0 g 碳酸氢钠片和 1.0 g 铝碳酸镁片粉碎后放入试管中,分别加入 120 mL pH=1 的稀盐酸,利用 CO2传感器和 pH 传感器(如图2所示)分别测出试管内 CO2浓度和溶液 pH 随时间的变化,得到图3、图4所示曲线。
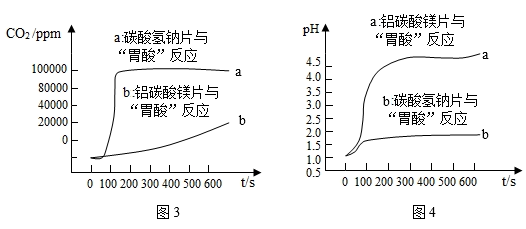
抗酸原理:碳酸氢钠与盐酸反应的化学方程式。
铝碳酸镁与盐酸的反应为:
起抗酸作用的离子是。
两种药剂治疗胃酸过多症效果更好的是,理由是。


方案 1:小金按如图 5 的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。小金将小烧杯中的稀盐酸分几次加入到 3.0 g 碳酸氢钠片粉末中。
当时(填操作和现象),可判断碳酸氢钠完全反应。
【记录与处理】
实验前称量装置乙和丙的总质量。之后关闭 K1 , 打开 K2、K3、K4和分液漏斗活塞,将 50 mL 10%的稀硫酸加入锥形瓶中,关闭活塞。充分反应后冷却到室温,打开 K1 , 鼓入空气。一段时间后称量装置乙和丙的总质量。重复三次操作,实验数据如下表。
|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/g |
3.0 |
3.0 |
3.0 |
|
反应前装置乙和丙的质量/g |
493.8 |
494.6 |
493.6 |
|
反应后装置乙和丙的质量/g |
492.6 |
493.6 |
492.5 |
计算药片中碳酸氢钠的质量分数为。
方案 2 比方案 1 实验结果更准确,理由是(至少写两点)。