
 互为同分异构体
D . 可用酸性高锰酸钾溶液检验其中的碳碳双键
互为同分异构体
D . 可用酸性高锰酸钾溶液检验其中的碳碳双键
实验操作及现象 | 结论或解释 | |
A | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | Na2SO3溶液已变质 |
B | 向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去 | H2O2具有还原性 |
C | 向Al2(SO4)3溶液中逐滴加入NaOH溶液至过量,先生成白色沉淀,后沉淀消失 | Al(OH)3具有两性 |
D | 向饱和NaHCO3溶液中滴加饱和CaCl2溶液,既产生白色沉淀又生成无色气体 | Ca2++2HCO |


实验流程及实验装置图如下:

回答下列问题:
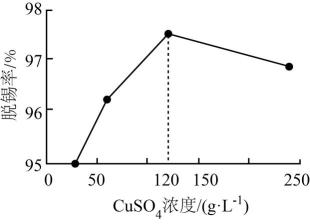
a导管末端多孔球泡的作用。
i.称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中:
ii.移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用0.1000mol·L-1盐酸标准溶液滴定至溶液由浅红色变无色(第一滴定终点), 消耗盐酸V1mL;
iii.在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2mL;
iv.平行测定三次,V1 平均值为22.25,V2平均值为23.51。
回答下列问题:
指示剂N为, 第二滴定终点的现象是。

已知: 2CH4(g) + O2(g) = 2CH3OH(l) ∆H1
2H2O2(l)= O2(g) + 2H2O(l) △H2
则H2O2氧化CH4的热化学方程式为 ( 用∆H1和∆H2来表示∆H)。
主反应: CO2(g)+ 3H2(g) CHOH(g)+ H2O(g) ∆H<0
副反应: CO2(g) +H2(g) CO(g) + H2O(g) ∆H<0
起始投料为= 3。
i.当反应只按主反应进行时,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如下图所示。其中, x(CH3OH)-p图在t=250℃下测得, x(CH3OH)-t 图在p=5×105 Pa下测得。

图中等压过程的曲线是(填“a”或“b”),判断的依据是。

①能发生银镜反应 ②与FeCl3溶液发生显色反应