
选项 | 实验操作和现象 | 结论 |
A | 向盛 | 证明 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO |
C | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水,溶液未变蓝 | 淀粉完全水解 |
D | 压缩装有H2、I2(g)和HI混合气体(已平衡)的密闭容器,观察到气体颜色加深 | 无法证明平衡发生了移动 |


下列说法正确的是( )

实验室合成SOCl2的原理之一为SO2+Cl2+SCl22SOCl2 , 部分装置(夹持、加热装置略去)如图所示。
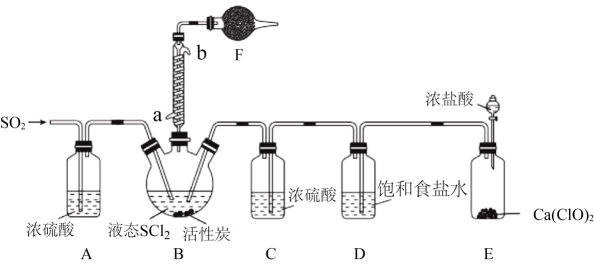
②装置A、C除干燥气体外,另一作用可能是;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:。
a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水

已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RHNiR2+2H+。
回答下列问题:
电解电压/V | 1.0 | 1.2 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
Fe2+ | 有 | 有 | 有 | 无 | 无 | 无 | 无 |
Cr4+ | 无 | 无 | 无 | 无 | 无 | 有 | 有 |
A.酸浸 B.调pH C.除Cr
反萃取剂X为 (填化学式)。
①该反应在 (填“高温”“低温”或“任意温度”)下可自发进行。
我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
i. 3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
ii. Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-88kJ·mol-1
iii. LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
②则ΔH3=。
i.
ii.
iii.
和
的线性关系图如下所示:

①由图可知ΔH10(填“大于”或“小于”)。
②反应i的Kp0=(用Kp1和Kp2表示)。
反应i的0(填“大于”或“小于”),写出推理过程。

S2O的空间构型为, 中心硫原子的杂化轨道类型为。

这类硫原子数可变的多硫氧合阴离子的化学式可用通式表示为(用n代表硫原子数)。
