 B . 塑料水杯
B . 塑料水杯  C . 木桶
C . 木桶  D . 紫砂壶
D . 紫砂壶 

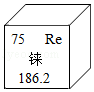
 B . 闻气体气味
B . 闻气体气味  C . 检查气密性
C . 检查气密性  D . 滴加液体
D . 滴加液体 
| 物质 | 甲 | 乙 | 丙 | 丁 | |
| 微观示意图 | | | | | |
| 反应前质量/g | 20 | 16 | 44 | 2 | |
| 反应后质量/g | 12 | 32 | 0 | x |
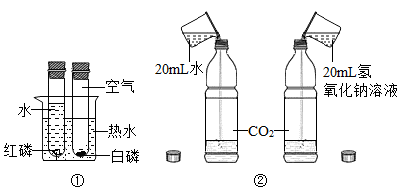
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO气体中混有的CO2气体 | 将气体点燃 |
| B | 分离NaCl和MgCl2 | 加入适量NaOH溶液,过滤 |
| C | 鉴别稀盐酸、氢氧化钠、氯化钠三种溶液 | 分别滴加酚酞溶液,再相互混合 |
| D | 生活中区别亚硝酸钠和食盐 | 取少量尝味道 |
①霉变花生、玉米等不能食用,是因为滋生了含有黄曲霉毒素的黄曲霉菌
②在汽油中加入适量乙醇作为汽车燃料,可节省石油资源,并减少汽车尾气的污染
③只用一种溶液就可将氯化铵、碳酸氢铵、硫酸铵、氯化钾、磷矿粉五种固体区分开
④含有相同金属离子的物质中,可溶性碳酸盐、硫酸盐均能与可溶性碱实现相互转化
⑤现将含有某种氯化物杂质的氯化镁粉末95g溶于水后,与足量的硝酸银溶液反应,产生290g沉淀,则该杂质可能为CaCl2
①硅元素。
②3个钠离子。
③保持氦气化学性质的最小粒子。
④密度最小的气体。
①“3”。
②“2”。
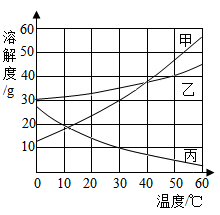
①10℃时,丙溶液中溶质与溶剂的质量比为1:5,则该溶液属于(选填“饱和”或“不饱和”)溶液;
②下列说法正确的是。
A.50℃时,三种固体溶解度大小关系为:甲>乙>丙
B.40℃时,甲、乙两物质的饱和溶液中所含溶质的质量相等
C.50℃时,将70g乙的饱和溶液稀释成10%的溶液,需加水130g
D.60℃时,将等质量的甲、乙、丙饱和溶液降温到40℃,所得溶液中溶质质量大小关系为:甲=乙>丙
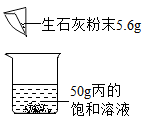
③如下图所示,30℃时向盛有50g丙的饱和溶液加入5.6g生石灰粉末,充分搅拌后,静置,发现固体增多了,原因是:(至少答两点)。

青铜的硬度比纯铜的硬度(填“大”或“小”)。
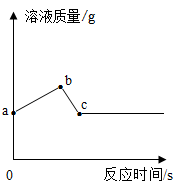
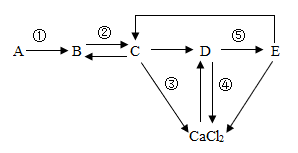
①由上图可知Zn、Cu、R的金属活动性由强到弱的顺序为。
②c点的滤渣组成情况有种。
③bc段反应的化学方程式为。
|
干冰 制造“人造骨” 氯化钠 配制生理盐水 钛合金 作制冷剂 |
材料一:人类目前所消耗的能量主要来自于化石燃料,化石燃料是由古代生物的遗骸经过一系列复杂的变化形成的。化石燃料燃烧时产生的一些物质,如一氧化碳、二氧化硫、未燃烧的碳氢化合物及碳粒、二氧化氮等氮的氧化物排放到空气中,会对空气造成污染。
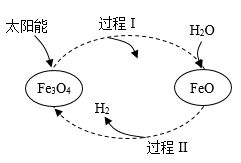
材料二:氢能根据生产来源分为三类,以化石能源制取的氢气被称作“灰氢”。以化石能源配合碳捕获和封存技术制取的氢气被称为“蓝氢”。利用可再生能源分解水制备得到的氢气被称为“绿氢”,是最为绿色环保的氢气。以太阳能为热源,利用纳米级Fe3O4 , 可获得“绿氢”,过程如图所示。
①“煤、石油、天然气”是能源(填“可再生”或“不可再生”)。
②化石燃料燃烧时产生的会形成酸雨(填化学式)。
③根据材料二判断,下列说法错误的是(填序号)。
A.过程Ⅰ中反应的化学方程式为
B.过程Ⅱ中反应的化学方程式为
C.整个过程实现了太阳能向化学能的转化
D.Fe3O4、FeO在整个过程中可循环利用
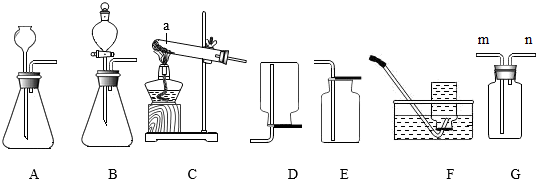
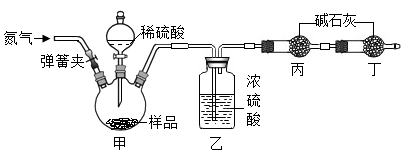
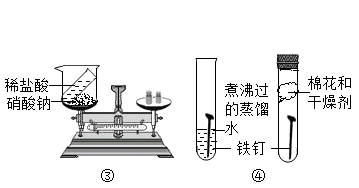
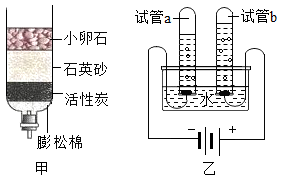
①称取10g该样品放入装置甲中进行实验,正确的操作顺序是b→(填字母序号,可重复选择)。
a.称量装置丙的质量
b.打开弹簧夹,通入足量的氮气,关闭弹簧夹
c.打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞
②在①的操作中,先通入氮气的目的是。
③在所有实验步骤、操作均正确的前提下,测得丙装置的质量增重4.4g,经计算得到该样品中碳酸氢钠的质量分数为84%。小明同学另取相同质量的样品,将稀硫酸换成稀盐酸,按小张同学的方法进行相同的、规范的实验操作,测得丙装置的质量增重大于4.4g,原因是。
【查阅资料】Na2S2O3为白色固体,易溶于水,在中性或碱性溶液中稳定,在酸性溶液中不稳定,遇酸时反应生成淡黄色的硫单质沉淀,并放出具有刺激性气味的SO2气体。
【提出问题】白色粉末的成分是什么?
【猜想与假设】猜想一:含有Na2S2O3 猜想二:含有Na2SO4
猜想三:含有NaCl 猜想四:含有NaNO3
|
步骤 |
实验操作 |
实验现象 |
结论 |
|
① |
取少量粉末于试管并加水溶解,向溶液中滴加足量稀硫酸 |
|
猜想一成立 |
|
② |
取①中澄清溶液,滴加足量溶液 |
有白色沉淀产生 |
猜想二成立 |
|
③ |
取②中澄清溶液,先加入足量稀硝酸,再加入硝酸银溶液 |
无明显现象 |
猜想三不成立 |
为了帮助小雯探究粉末的成分,结合定量研究的思想和方法,小明另取5g粉末加水配成溶液,将步骤①中的稀硫酸换为稀盐酸进行实验,再按步骤②进行实验操作,最终测得硫代硫酸钠的质量为1.58g,硫酸钠的质量为1.42g。