





已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
|
温度/ ℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
 +H2O+H2SO4
+H2O+H2SO4 +NH4HSO4
+NH4HSO4
 +Cu(OH)2
+Cu(OH)2 +H2O
+H2O
制备苯乙酸的装置示意图(加热和夹持装置等略):
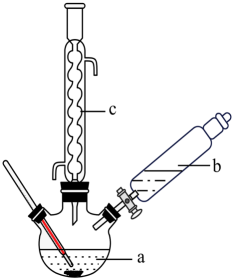
已知:苯乙酸![]() 的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
的熔点为76.5℃,微溶于冷水,溶于乙醇。 具体步骤:
i.在250mL三颈烧瓶a中加入70mL70%的硫酸。
ii.将a中的溶液加热至100℃,缓缓滴加40g苯乙腈(![]() )到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
)到过量硫酸溶液中,然后升温至130℃继续反应。反应结束后加适量冷水,再分离出苯乙酸粗品。
iii.将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。回答下列问题:

2Al(s)+ O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
Al和FeO发热反应的热化学方程式是。

①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)>>
a.NH4Cl b. NH4A c. (NH4)2CO3

分子内含有的作用力有 (填序号),
A.氢键 B.离子键 C.金属键 D.配位键
其中属于第二周期元素的第一电能由大到小的顺序是 (填元素符号);

a. 0.1 molM与足量金属钠反应生成氢气2.24 L (标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱有3组峰,且峰面积之比为3:1:1的结构简式是。