


下列判断错误的是( )
 +e-=Cl-+
+e-=Cl-+
已知:AG=lg , 电离度=
x 100%。
若忽略溶液混合时的体积变化,下列说法正确的是( )
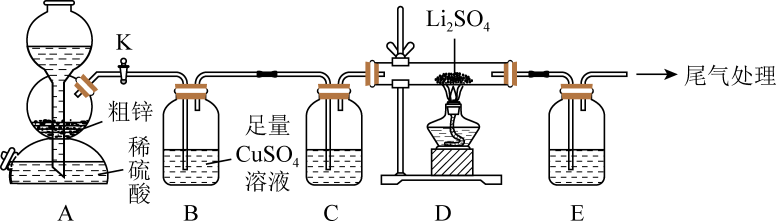
a.70%硫酸、亚硫酸钠 b.
:稀盐酸、大理石
c.:浓氨水、生石灰 d.
:浓盐酸、
①提出猜想:
猜想一:产品中含杂质
猜想二:产品中含杂质
猜想三:产品中含杂质S
依据所学知识,猜想三不成立,理由是。
②化学小组为验证猜想:
限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液
实验 | 操作与现象 | 结论 |
I | 取少量 | 样品中不含 |
II | 在实验I反应后的溶液中, | 样品中含 |
①煮沸的目的是。
②样品的纯度为。

回答下列问题:

①C2H6(g)C2H4(g)+H2(g) △H1=+137kJ·mol-1
②C2H4(g)+3O2(g)2CO2(g)+2H2O(l) △H2=-1411kJ·mol-1
欲利用反应①、②中的数据求C2H6(g)的燃烧热,还需要知道一种物质的燃烧热(用△H3表示),请写出该物质的燃烧热的热化学方程式。C2H6(g)的燃烧热(△H4)为(用含△H3的代数式表示)。

①温度低于1000K时,两种催化剂对该反应活化能影响较大的是(填“甲”或“乙”),使用该催化剂时,该转化反应适宜的温度是;使用催化剂甲时,当温度高于1000K时,C2H6的转化率减小的原因可能是(填标号)。
A.平衡向左移动
B.催化剂催化活性降低,导致反应速率减小
C.温度过高,乙烯与氢气发生反应
②乙烷的转化率随时间的变化关系如图2所示,在m点条件下,平衡时总压为2.1×105Pa,经过10min反应达到平衡状态,则0~10min内m点对应反应的v(C2H6)=Pa·min-1 , Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数Kp=Pa。



①分子中含有苯环;②1mol催化氧化后的产物能消耗4mol新制。
 , 设计合成路线(无机试剂任选)。
, 设计合成路线(无机试剂任选)。