




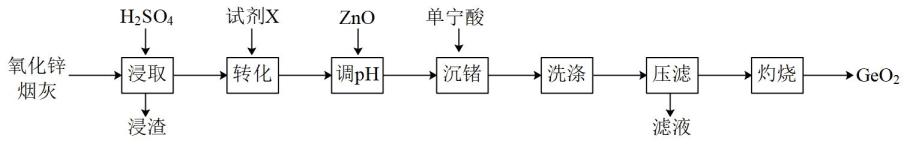
已知:①浸取后溶液pH为2,Ge以GeO2+的形式存在;
②单宁酸为复杂有机酸,易与Fe3+络合沉淀。

一段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
锗沉淀率/% | 88.5 | 89.5 | 90.5 | 91.5 | 93.5 |
二段沉锗单宁酸总用量/倍 | 10 | 15 | 20 | 25 | 30 |
锗沉淀率/% | 92 | 93.5 | 94.5 | 97 | 97.5 |

仪器a的名称为NaOH溶液的作用是。
制备反应的离子方程式为。
①过滤操作最好采用抽滤法快速过滤,这样可避免;
②判断CuCl沉淀洗涤干净的实验方案是。

①随着pH增大,CuCl2浓度逐渐降低的原因是;
②控制溶液的pH在时,CuCl产率最高。

①CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=eV/mol(阿伏加德罗常数用NA表示);
②(填“甲酸盐”或“羧酸”)路径更有利于CO2加氢制甲醇反应,对该路径的反应速率影响最大的一步反应是;
③根据势能图,下列说法合理的是(填标号)。
A.CO2分压越大,催化剂表面积越大,CO2在催化剂表面的吸附速率越大
B.不考虑H3COH*,两种路径中产生的含碳中间体种类均有5种
C.中间体HCOO*比COOH*更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率

①该反应的活化能Ea=kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与关系的示意图。

CO2转化率和甲醇选择性随温度的变化曲线
①若233-251℃时催化剂的活性受温度影响不大,分析235℃后图中曲线下降的原因。
②在压强为P的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为20%,甲醇的选择性为50%,计算CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)在该温度下的平衡常数Kp=。(列出计算式)

g-C3N4中N原子的杂化类型,片层之间通过(填作用力类型)结合,g-C3N4在光激发下能传递电子的原因是。

则第二层离子有个,与中心离子的距离为pm,它们是离子(填“钠”或“氯”),晶胞中的离子空间占有率为(列出计算表达式)。
i)只含两种官能团且不含甲基;
ii)含-CH2Br结构,不含C=C=C和环状结构。
 制备
制备 的合成路线试剂任选)。
的合成路线试剂任选)。