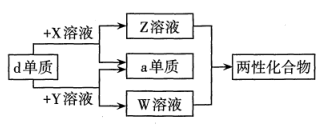
下列说法正确的是( )



I.取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解,配成一定浓度的硝酸铈溶液,过滤后待用。在搅拌条件下,向硝酸铈溶液中加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黃色难溶物)。
II.将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体,二者反应生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。
回答下列问题:
②步骤I中进行“氧化沉淀”时,加热的温度不宜过高,原因是。

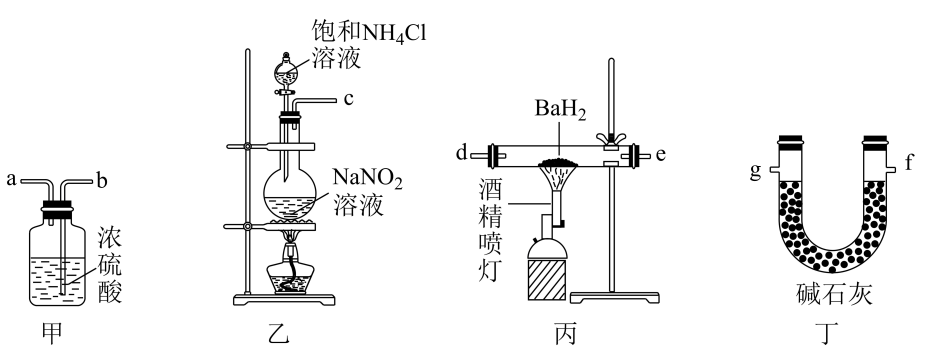
①装置a圆底烧瓶中盛放的固体药品为(填化学式)。
②当装置b中沉淀完全变为黄色后,停止通Cl2后改通空气(图中框内改为通空气装置)的目的是;将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是。

已知:“水浸”后滤液中的阴离子主要是、
、
、
和
。
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为g(不考虑空气中水蒸气的干扰)。
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过离子交换柱发生反应:
+Ba(IO3)2=BaWO4+2
;交换结束后,向所得含
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
=2I-+
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为,(列出计算式,无需化简)
①该反应一般认为通过如下步骤来实现:
I.CH4(g)=C(ads)+2H2(g)
II.C(ads)+CO2(g)=2CO(g)
上述反应中C( ads)为吸附活性炭,反应历程的能量变化如图所示:

①反应I是(填“ 慢反应”或“快反应”),CH4-CO2干重整反应的热化学方程式为。(选取图中E1、E2、E3、E4、E5表示反应热)。
②在恒压条件下,等物质的量的CH4(g)和CO2(g)发生干重整反应时,各物质的平衡转化率随温度变化如图1所示。已知在干重整中还发生了副反应:H2(g)+CO2(g)=H2O(g)+CO(g) ΔH> 0,则表示CO2平衡转化率的是曲线 (填“ A”或“B") ,判断的依据是。
③在恒压p 、800 K条件下,在密闭容器中充入等物质的量的CH4(g)和CO2(g) ,若曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为20%,则以上反应平衡体系中n(H2): n(H2O)=,则干重整反应的平衡常数Kp (用平衡分压代替平衡浓度表示,分压=总压×物质的量分数,列出计算式,无需化简)。

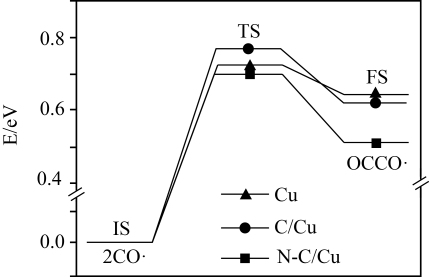

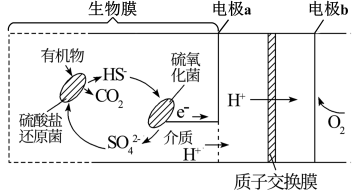
①写出与电源正极相连一极上的电极反应式:。
②下列说法正确的是(填字母)。
A.循环液1和循环液2中的阴离子种类相同
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.水的电离程度:处理后海水1>处理后海水2
D.该方法可以同时将海水进行淡化
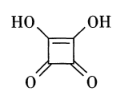
①1 mol方酸中含有的σ键数目为,其中 C的杂化轨道类型是。
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是。
①LiClO4中阴离子的空间结构名称是。
②是一种配离子,请从配位键来解释其形成过程:。
③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由:。
 , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。
, H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。
 分子间能形成氢键, CH3OCH3分子间不能形成氢键
分子间能形成氢键, CH3OCH3分子间不能形成氢键
①含有氨基,且能使FeCl3溶液显色
②能发生银镜反应和水解反应
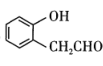 的路线(其他无机试剂任选):
的路线(其他无机试剂任选):