 B .
B .  C .
C .  D .
D .  C . 丙烷分子的空间填充模型
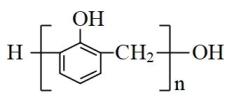
C . 丙烷分子的空间填充模型 )不是苯的同系物,其一氯代物有2种
B . 棉花、麻的主要成分是纤维素,蚕丝的主要成分是蛋白质
C . 石油的常压蒸馏可以得到润滑油、石蜡、沥青等馏分
D . 煤气化生成的可燃性气体中的
)不是苯的同系物,其一氯代物有2种
B . 棉花、麻的主要成分是纤维素,蚕丝的主要成分是蛋白质
C . 石油的常压蒸馏可以得到润滑油、石蜡、沥青等馏分
D . 煤气化生成的可燃性气体中的 
 D . 包装上有标记“OTC”的药物,消费者可以自行购买和使用
D . 包装上有标记“OTC”的药物,消费者可以自行购买和使用

0 | 3 | 6 | 10 | 15 | 25 | ||
3 | 2.50 | 2.35 | 2.15 | 2.10 | 2.08 | 2.06 |
下列推断正确的是( )


选项 | 实验操作和现象 | 解释或结论 |
A | 工业上用SiO2与焦炭在高温条件制备粗硅,生成气体CO,得到黑色固体粗硅 | 非金属性:C>Si |
B | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液:有气体生成,溶液不呈血红色 | 稀硝酸只能将Fe氧化为Fe2+ |
D | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌;有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
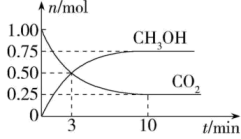
②葡萄糖的分子式是。

请回答:

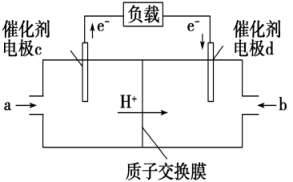
①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度及开始沉淀的pH
金属离子 | 浓度(mol·L-1) | 开始沉淀pH |
Fe2+ | 1.0×10-3 | 8.0 |
Fe3+ | 4.0×10-2 | 1.7 |
Zn2+ | 1.5 | 5.5 |
Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
金属离子 | 萃取率(%) |
Fe2+ | 0 |
Fe3+ | 99 |
Zn2+ | 0 |
Ga3+ | 97-98.5 |
 的路线(无机试剂任选)。。
的路线(无机试剂任选)。。