

选项 | 实验操作和现象 | 实验结论 |
A | 向浓度均为0.1mol·L-1的KCl和KI的混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向两支盛有2mL不同浓度Na2SO3溶液的试管中同时加入1mL2%双氧水,观察实验现象 | 探究浓度对化学反应速率的影响 |
C | 将Na2S2O3溶液与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间 | 探究温度对化学反应速率的影响 |
D | 室温用pH试纸测同浓度的NaClO和CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 酸性:HClO>CH3COOH |


[已知:δ(X)=]
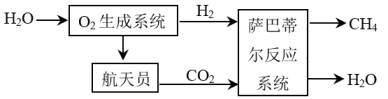
①已知下列数据:
化学键 | H-H | C-H | H-O | C=O |
断裂化学键吸收的能量/(kJ·mol-1) | 435 | 415 | 465 | 800 |
则“萨巴蒂尔反应”的热化学方程式为。
②“萨巴蒂尔反应”在固定容积的密闭容器中发生,若要提高CO2的平衡转化率,可采取的措施有(写两条)。
①CO2的富集与转化是O2再生的核心问题。“电化学富集法”是一种适合飞行器较长时间飞行的方法,装置如图所示。b极为极(填“正”或“负”),a电极上发生的电极反应为。
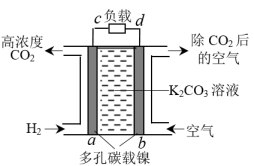
②负载中电解水可实现O2的再生,阳极为(填“c”或“d”),电极反应为。
③下列措施可提高O2生成速率的是。
A.提高电解时的电源电压 B.向水中加入少量的NaCl
C.适当提高电解液的温度 D.用金属铜作阳极
电解质 | 平衡方程式 | K | Ksp |
CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.76×10-5 | |
H2CO3 | H2CO3⇌H++
| K1=4.31×10-7 K2=5.61×10-11 | |
H3PO4 | H3PO4⇌H++
| K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O⇌ | 1.76×10-5 | |
AgBr | AgBr⇌Ag++Br- | 5.4×10-13 | |
AgCl | AgCl⇌Ag++Cl- | 1.8×10-10 |
回答下列问题:

①T1T2(填“>”“=”或“<”);
②T1温度时,对于AgBr的沉淀溶解平衡体系,下列说法正确的是;
A.加入NaBr可使溶液由b点变为a点
B.升温可使溶液由b点变为d点
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点
D.T1曲线上方区域(不含曲线)任意一点对应的溶液中,均有AgBr沉淀
③用饱和NaCl溶液处理少量AgBr沉淀,使其中的Br-全部转化到溶液中。该沉淀转化反应的平衡常数K=。

常温下溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01mol·L−1)的pH | 7.2 | 2.2 | 7.5 |
沉淀完全时(c=1.0×10−5mol·L−1)的pH | 8.7 | 3.2 | 9.0 |
回答下列问题:
实验 编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
0.01mol·L-1 H2C2O4溶液 | 0.01mol·L-1 KMnO4溶液 | 3.0mol·L-1 稀H2SO4 | 水 | 温度/℃ | ||
1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
4 | 5.0 | 2.0 | 2.0 | 5.0 | 30 | t4 |
对比实验,可探究浓度对反应速率的影响;对比实验可探究温度对反应速率的影响。实验测得t3<t2 , 由此得出的结论是。


盛装KMnO4溶液应选用滴定管,判断达到滴定终点的现象为;根据题给数据,测得该乳酸钙产品的纯度为(保留三位有效数字)。

①与实验a相比,实验b采取的措施可能是,理由是;
②0~10min内,实验b对应条件下υ(NO)=;
③实验a条件下,反应的平衡常数Kc=。

①P1P2(填“>”“<”);升高温度,(填“增大”“减小”或“不变”);
②c、d、e三点平衡常数Kc、Kd、Ke三者之间的关系为,理由是;
③f点,=(保留三位有效数字)。