 B .
B .  C .
C .  D .
D . 
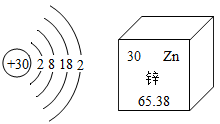
C→CO-→CO2→H2CO3→CaCO3→CaO

①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
分别取等质量的白色颗粒和等体积的水加入a、b两支试管,再向b试管中加入黑色粉末。观察到a试管仅有少量气泡,b试管有大量气泡。

①黑色粉末起作用。
②欲使a试管产生气泡加快,可加入 (填序号)。
A.CuSO4溶液 B.NaCl溶液 C.MnO2
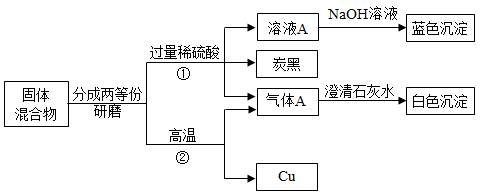
根据元素守恒,上述反应后溶液中溶质的成分可能为:
①只含NaOH ②只含Na2CO3③NaOH和Na2CO3的混合物……
甲、乙两同学仅针对前三种可能性,分别设计实验1和实验2进行验证。
序号 | 操作和现象 | 实验结论 |
实验1 | 取b试管上层清液滴加过量稀盐酸,产生能使澄清石灰水变浑浊的气体 | 只含Na2CO3 |
实验2 | 第一步:取b试管上层清液滴加过量CaCl2溶液,产生白色沉淀并过滤 第二步:在滤液中滴加酚酞,溶液(填现象) | 只含Na2CO3 |
丙同学认为实验1的结论不严谨,理由是。
结合实验现象,该制氧机的制气原理有两步反应,写出第二步的化学方程式:
①2Na2CO3●3H2O22Na2CO3+3H2O2;
②
制氧机制氧选择过碳酸钠而不选择双氧水的根本原因是(填序号)。A.产物无污染 B.制取成本更低 C.运输储存更方便