

①向FeSO4溶液中滴加2滴K3[Fe(CN)6]溶液,产生蓝色沉淀,反应的离子方程式为:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
②向次氯酸钙溶液中通入少量的CO2生成白色沉淀,证明Ka2(H2CO3)>Ka(HClO)
③把电石与水反应产生的气体通入酸性KMnO4溶液,紫色褪去,证明有乙炔生成
④向[Cu(NH3)4]SO4溶液中加入95%的乙醇溶液,析出深蓝色晶体,是因为溶液的极性降低,溶质的溶解度减小

 的二氯代物有5种
D .
的二氯代物有5种
D .  两种化合物中碳原子都是共平面的
两种化合物中碳原子都是共平面的



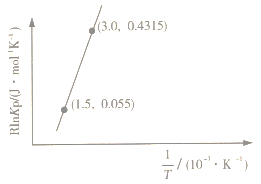
已知:RlnKp=-+C(R、C均为常数)。
下列说法错误的是( )


A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是(填化学式),此时生成的配离子溶液的颜色为色。


该物质的化学式为,Mg2+的配位数为,两个Mg2+之间最近的距离是pm。

已知:①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表:
金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
萃取率(%) | 0 | 99 | 0 | 97~98.5 |
②当溶液中剩余离子的浓度小于10-5mol·L-1时,视为沉淀完全。
③MOCVD:化学气相沉积,以合成的三甲基镓为原料,使其与NH3反应得到GaN。
请回答下列问题:

则ZnC2O4·2H2O分解是反应(填“放热”或“吸热”),分解的总化学方程式为。
V2O5VOCl2溶液
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
已知:①氧化性:V2O5>Cl2;②VO2+能被O2氧化。

①上述装置依次连接的合理顺序为c→(按气流方向,用小写字母表示)。
②连接好装置,检查气密性良好后,加入试剂,开始实验,先(填实验操作),当C中溶液变浑浊,(填实验操作),进行实验。
③装置D中每生成1mol氧钒(IV)碱式碳酸铵晶体,需要消耗molNH4HCO3。
称量ag产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2 , 最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为bmL。NaNO2溶液的作用是(用离子方程式表示),粗产品中钒的质量分数表达式为(以VO2+计)。若(NH4)2Fe(SO4)2标准溶液部分变质,则测定结果(填“偏高”、“偏低”或“无影响”)。已知:VO+Fe2++2H+=VO2++Fe3++H2O。

已知:①Me表示甲基,Et表示乙基;
②Hofmann重排反应:RCONH2R→N=C=O(X代表卤素原子)
③狄尔斯一阿尔德反应(Diels-Alder反应![]() +
+![]() →
→![]() )
)
请回答下列问题:
①苯环上有两个取代基(不含其它环状结构);且有一个为—NH2;
②有酯基且能发生银镜反应
写出一种核磁共振氢谱中峰面积比2:2:2:3:1:1的结构简式。
 的路线(其它试剂任选)。
的路线(其它试剂任选)。

请回答下列问题:

①有利于短链烯烃(n≤4)生成的温度范围为(填标号)。
A.373~573K B.573~773K C.773~973K D.973~1173K
②已知反应1的v(正)=k正·p(CO2)·p(H2),v(逆)=k逆·p(CO)·p(H2O),计算1083K时,=[p(CO2)等代表分压)]。
③工业上用分子筛作催化剂,可大大提高C2H4的选择性,已知乙烯的截面直径比分子筛的孔径略小,请解释分子筛能提高C2H4的选择性的原因。
④在碱性环境中电催化还原CO2制乙烯,产生乙烯的电极为极(填“阴”或“阳”),该电极的电极反应式为。

上述过程中得到相对较多的副产物为,合成甲醇决速步的化学反应方程式为。