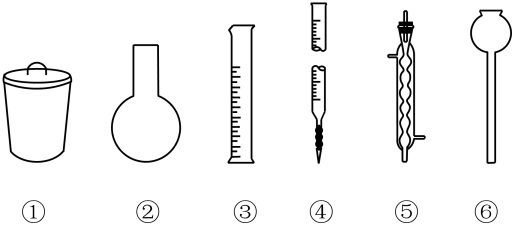

|
A |
B |
C |
D |
|
|
|
|
|
|
A.除去CO2中的水蒸气 |
B.进行喷泉实验 |
C.探究CH4与Cl2的反应 |
D.用铁氯化钾溶液验证牺牲阳极法保护铁 |


选项 | 实验目的 | 玻璃仪器 | 试剂 |
A | 比较Mg、Al金属性的强弱 | 试管、胶头滴管 | MgCl2溶液、AlCl3溶液、浓NaOH溶液 |
B | 观察[Cu(NH3)4]SO4•H2O晶体的形成和析出 | 试管、胶头滴管、玻璃棒 | CuSO4溶液、氨水 |
C | 通过气味消失的快慢比较乙酸乙酯的水解速率 | 试管、烧杯、量筒、胶头滴管、酒精灯 | 乙酸乙酯、蒸馏水、H2SO4溶液、NaOH溶液 |
D | 实验室由粗盐(含Mg2+、Ca2+、SO | 漏斗、烧杯、玻璃棒、酒精灯 | 粗食盐水、NaOH溶液、Na2CO3溶液、BaCl2溶液 |


 )。
)。①AlCl的空间构型为;Al2Cl
中各原子最外层均达到8电子结构,则其结构式为。
②1molEMIM+中所含σ键为mol,EMIM+中环上所有原子共面,其中氨原子的杂化方式;为分子中的大π键可用Π符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
),则EMIM+中的大π键应表示为。
③为使EMIM+以单个形式存在以获得良好的溶解性能,与N原子相连的-CH3、-C2H5 , 不能被H原子替换,其原因是。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,
,
),则C点Al原子在z轴方向上的分数坐标z=(用含c、s的代数式表示);已知:阿伏加德罗常数的值为NA , 则该晶体的密度为g•cm-3(列出计算表达式)。
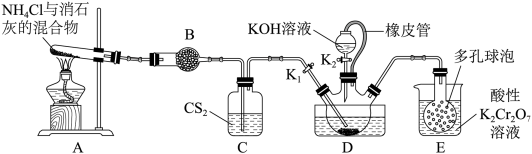
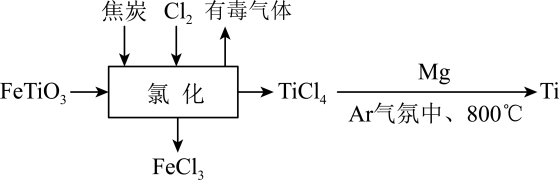
已知:①CS2不溶于水,密度比水大;②三颈烧瓶内盛放有CS2、水和催化剂。
①实验前,经检验装置的气密性良好。装置A中发生反应的化学方程式为;装置B中的试剂是。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是。
②实验开始时,打开K1 , 加热装置A、D,使A中产生的气体级级通入D中,发生反应:
CS2+3NH3NH4SCN+NH4HS,该反应缓慢进行至CS2消失。
①熄灭A处的酒精灯,关闭K1和K2 , 移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HSH2S↑+NH3↑),打开K2 , 继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为。
②装置E中,NH3被酸性重铬酸钾氧化为氨气,反应的离子方程式为。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),判断达到滴定终点的现象是。
②晶体中KSCN的质量分数为。
①苯环上有二个取代基:②与FeCl3溶液发生显色反应;
③能发生水解反应,但不能发生银镜反应。
 , 为原料合成
, 为原料合成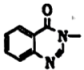 的路线(无机试剂任选)。
的路线(无机试剂任选)。
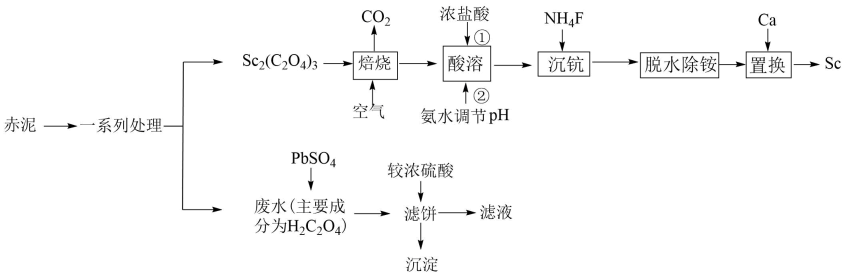
已知:25℃时,部分物质的相关数据如表。
Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |


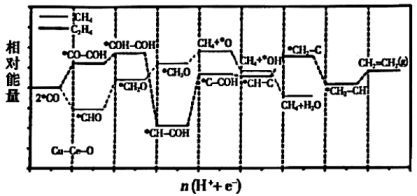
第一步:Cl22Cl• △H1=+243kJ·mol-1
第二步:Cl•+COCOCl• △H2=-20kJ·mol-1
第三步:COCl•+Cl2COCl2+Cl• △H3=-88kJ·mol-1
①反应Cl2(g)+CO(g)COCl2(g)的△H=kJ·mol-1。
②已知活化络合物分子中含有的原子数目等于反应速率方程中物质的原子数与指数的积,如H2+Cl2=2HCl的反应速率方程为v=kc(Cl2)•c(H2),可推测反应决速步中活化络合物的可能存在形式为ClH2、H2Cl或H2+Cl•,则Cl2(g)+CO(g)
COCl2(g)反应中的活化络合物的可能存在形式为(任写一个即可),请判断第步的活化能最高。

①能正确表示上述反应线性关系的直线为(填“L1”或“L2”),理由是。
②图中Q点的坐标为(2.2,-2.0),已知=1.4,则平衡时CO的转化率为。若保持温度不变,将该容器增压再次达到平衡,其状态可能为图中Q、M、N中的点,此时混合气中COCl2的体积分数是50%,则再次达到平衡状态的气体总压强是kPa。