

选项 | 实验操作及现象 | 结论 |
A | 向某溶液中加入70%硫酸溶液后加热,并将气体产物依次通过品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊 | 该溶液中含亚硫酸盐 |
B | 向蛋白质溶液中加入饱和氯化铵溶液,有固体析出 | 蛋白质发生了变性 |
C | 将变黑的银器浸入盛有NaCl溶液的铝制容器中,银器由黑变白 | 生成了Ag |
D | 用pH计测CH3COONa溶液和NaF溶液的pH,前者大于后者 | Ka(HF)>Ka( CH3COOH) |



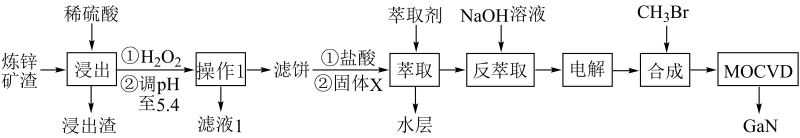
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1金属离子浓度 及开始沉淀的pH
金属离子 | 浓度( mol· L-1) | 开始沉淀pH |
Fe2+ | 1.0×10-3 | 8.0 |
Fe3+ | 4.0×10-2 | 1.7 |
Zn2+ | 1.5 | 5.5 |
Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
金属离子 | 萃取率(%) |
Fe2+ | 0 |
Fe3+ | 99 |
Zn2+ | 0 |
Ga3+ | 97-98.5 |

I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2 , 通入一段时间氮气,关闭K1、K2 , 取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2 , 取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
I.工业上主要采用乙烯直接水合法(CH2 =CH2+H2O→CH3CH2OH)制乙醇。
i. CH2 =CH2+H3O++H2O
ii. +H2O
iii. +H2O
CH3CH2OH+H3O+
随着反应进程,该过程能量变化如图1所示。

下列有关说法正确的是 (填字母标号,下同)。
a.该反应过程中i~ iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c. 和
是反应的中间产物

投料比由大到小的顺序为。
a.容器内气体密度不再变化
b.容器内气体中均相对分子质量不再变化
c. CO2的体积分数不再变化
d.容器内不再变化
e.断裂3NA个H-H键的同时生成l.5NA个水分子

Cu在元素周期表中位于区,M层中核外电子能量最高的电子云在空间有个伸展方向。C、N、O第一电离能由大到小的顺序为。

还原石墨烯中碳原子的杂化方式是,上图中氧化石墨烯转化为还原石墨烯时,1号C与其相邻C原子间键能的变化是(填“变大”“变小”或“不变”),二者当中在水溶液中溶解度更大的是 (填物质名称) ,原因为。
B:(0,0,0);( ,
, 0);(
, 0,
);(0,
,
)
As:( ,
,
);(
,
,
);(
,
,
);(
,
,
)
请在图中画出砷化硼晶胞的俯视图,已 知晶体密度为d g/cm3 ,As半径为a pm,假设As、B原子相切,则B原子的半径为 pm(写计算表达式)。

