 的系统命名为对二甲苯
C .
的系统命名为对二甲苯
C . 


t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |

容器编号 | 起始浓度(单位:mol/L) | 平衡时 | 达到平衡所用时间 | 平衡时体系能量变化 | ||
甲 | 1 | 3 | 0 | 25% | 放热为73.92kJ | |
乙 | 0 | 0 | 4 | a% | 吸热为bkJ | |
下列中说法正确的是( )
实验 | 操作 | 现象 | 结论 |
A | 向硫酸酸化的 | 产生白色沉淀 |
|
B | 将 | 白色沉淀变为蓝色沉淀 | |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间,冷却后再加入新制 | 生成砖红色沉淀 | 淀粉在酸性条件下可以水解,产物中有葡萄糖 |
D | 用玻璃棒蘸取某无色溶液进行焰色试验 | 焰色呈黄色 | 溶液中含有 |


已知:①白色固体B可溶于无色气体C的水溶液中得到无色溶液
②流程中部分生成物已略去,气体产物完全逸出,沉淀均洗涤干净。请回答:
与环氧丙烷(
 ) 反应生成可降解塑料(
) 反应生成可降解塑料( ),写出反应的化学方程式。
),写出反应的化学方程式。
①
②
已知298K时,相关物质的能量如图所示,则,反应①能够自发进行的条件是(填“高温”、“低温”或“任何温度均可”)。
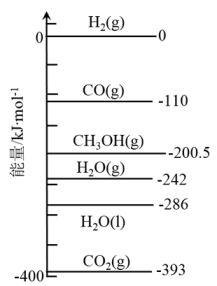
②下列说法中错误的是。
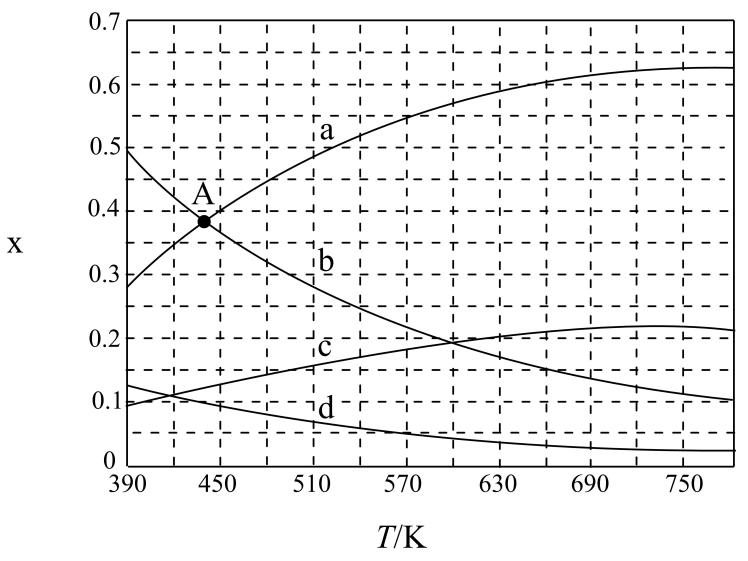
A.向容器中充入He,使体系压强增大,可增大反应速率且能提高
B.当混合气体的平均摩尔质量不变时,说明反应达到了平衡状态
C.当时,说明反应达到了平衡状态
D.选择合适的催化剂,不但可以加快反应速率,还可提高甲醇的平衡产率

已知:①NO不能溶于NaOH溶液,微溶于水,能溶于硝酸。
②为砖红色固体;
,
a.水 b.冰盐水 c.冰水
①滴定终点的现象为。
②亚硝酰氯(NOCl)的质量分数为(用含m、c的代数式表示)。

已知:①H分子为不含甲基的链状化合物
②RCH2COOH
③R-ONaR-O-R′(R—、R'—代表烃基)
请回答下列问题:
①能与发生显色反应
②核磁共振氢谱有四个峰,面积之比为3∶2∶2∶1
 )的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
)的合成路线(用流程图表示,无机试剂、有机溶剂任选)。