 移走蒸发皿
B .
移走蒸发皿
B .  称量固体药品
C .
称量固体药品
C .  点燃酒精灯
D .
点燃酒精灯
D .  检查装置气密性
检查装置气密性

①将柑橘凑近鼻子,能闻到阵阵香气。用微粒观点解释原因。
②柑橘中富含维生素C(C6H8O6),维生素C由种元素组成。
③柑橘适宜生长在pH为6.0~6.5的土壤中,这种土壤显(填“酸”、“碱”或“中”)性。可用于测量土壤pH的实验用品是。
A.石蕊试剂 B.pH试纸 C.酚酞试剂

回答有关问题:
①30℃时,NaCl的溶解度约是。工业上在此温度下,将12t固体NaCl加入20t水中,充分溶解,形成的溶液是(填“饱和”或“不饱和”)溶液。
②NH4Cl溶解度随温度变化的趋势是。
③将饱和食盐水的温度提高,能继续溶解氯化钠,溶液中溶质的质量分数也会提高,有利于提高反应速率。而实际生产中往往在常温下进行,原因可能是。
④“侯氏制碱法”制得的NH4Cl中会混有少量的NaCl,根据上图分析,提纯NH4Cl可采取的方法为。
①分别取A、B、C三种样品于研钵,各加入少量熟石灰,研磨。A、B样品无明显变化,C样品有刺激性气味产生。C为。
②取无现象的两个研钵中的固体于两支试管中,加入稀盐酸进行鉴别。用化学方程式表示鉴别依据的原理。


 铁锅
B .
铁锅
B .  铜导线
C .
铜导线
C .  铝箔
D .
铝箔
D .  黄金首饰
黄金首饰

①图1中,反应I的基本反应类型是反应。
②反应Ⅲ将铁矿石的主要成分Fe2O3转化成Fe,铁元素化合价变化为。反应的化学方程式为。
③石灰石既能使SiO2转变成炉渣,同时还能提高生铁的单位时间内产量。分析加入石灰石能提高生铁产率的原因。
④图2中,利用铁水和炉渣(填物理性质)不同,两者通过不同高度的出口实现分离。

资料:固态管道疏通剂主要成分为NaOH、铝粉和缓蚀阻垢剂。
在实验室里,同学们取出一定量管道疏通剂,放入盛有水、毛发、脂肪的管中(如图),观察到反应剧烈,有大量气泡产生,管壁发烫,堵塞物被赶出,落入废液杯中。
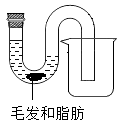
①同学们对管壁发烫的原因,提出两种猜想:一、反应放出热量;二、。
②甲同学查阅资料得知反应原理。请配平反应原理的化学方程式:2Al+2NaOH+2H2O=NaAlO2+3H2↑。
③乙同学对上述反应生成氢气的原因提出猜想:Al是活泼金属,所以能置换出NaOH中的“H”。大家认为他的观点不正确,原因是。
取20g样品倒入烧杯中,然后加入200g水,直到没有固体剩余,称量剩余物质总质量为219.4g。
①反应生成氢气的质量为g。
②样品中铝粉的质量分数为。
同学们猜想Ca(OH)2也能制管道疏通剂,通过查阅资料了解到Ca(OH)2溶液能发生反应:。在老师的帮助下进行以下探究:
实验三:按表中数据将药品混合均匀后,分别加入20mL水,观察到有大量气泡产生,测量反应前后温度的变化(温度升高值越大,疏通效果越好)。实验数据如下:
序号 | Ca(OH)2质量/g | 铝粉质量/g | 缓蚀阻垢剂质量/g | 混合前后温度升高/℃ |
① | 1.3 | 0.55 | 0.18 | 63 |
② | 1.3 | 0.75 | 0.18 | 78 |
③ | 1.3 | 0.95 | 0.18 | 89 |
④ | 1.3 | 1.15 | 0.18 | 83 |
同学们提出猜想的依据:Ca(OH)2、NaOH两种溶液中含有相同的(写微粒符号),它们的化学性质相似。
对于缓蚀阻垢剂用量对疏通效果的影响,能否用Ca(OH)2代替NaOH制管道疏通剂,同学们认为还需继续查找资料、进一步开展探究。