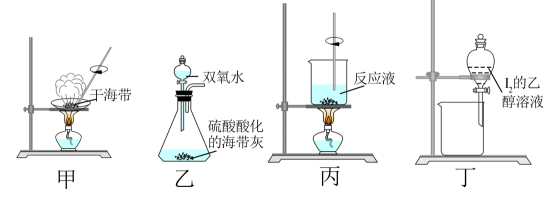

下列说法正确的是( )

实验l:将浓溶液滴入沸水中,分散系呈现红褐色
实验2:在装有少量溶液的试管中加入铜粉充分振荡,溶液由黄色变成蓝色
实验3:在装有少量溶液的试管中加入过量
溶液,充分振荡后,分成两份:一份加入有机溶剂
, 振荡后
层显紫红色;另一份加入
溶液,溶液显红色
实验4:在装有少量溶液的试管中加入少量
溶液,充分振荡后产生白色沉淀下列说法正确的是( )
①
②
③
a.酸 b.碱 c.盐 d.氢化物 e.氧化物 g.单质
步骤一:准确量取的
溶液10 mL,稀释配制成100 mL的溶液。
步骤二:量取处理后的水样于烧杯中,并将溶液调至中性,加入一定量的碘化钾,反应为
, 加入少许淀粉后溶液变蓝色。
步骤三:蓝色溶液中加入步骤一稀释后的溶液10 mL恰好使蓝色完全消失,且半分钟内不变色(已知:
)。
①步骤一中配制溶液所需的玻璃仪器有烧杯、玻璃棒和、。
②水样中的浓度是
。

第一步的离子方程式为(棕色),
第二步的离子方程式为。

①配制合成所需的溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是。
②用维生素C作底液而不用铁粉,其主要原因是。
③合成时需保持左右,控制pH不能太大也不能太小的原因是。

金属离子 | 开始沉淀的pH | 沉淀完全的pH |
1.1 | 3.2 | |
3.0 | 5.0 | |
5.8 | 8.8 |
①矿渣的主要成分是(填化学式)。
②加入溶液调pH的范围是。
③“酸化、调pH、结晶”过程中都需要进行的分离操作是。