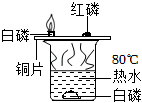
 探究燃烧条件
B .
探究燃烧条件
B . 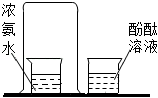 验证分子在不断地运动
C .
验证分子在不断地运动
C .  硬水软化
D .
硬水软化
D .  比较铁、铜、银的金属活动性
比较铁、铜、银的金属活动性
选项 | 实验目的 | 实验方案 |
A | 除去NaCl固体中的CaCl2 | 依次加入足量水、碳酸钠溶液、稀盐酸,蒸发结晶 |
B | 除去Fe粉中混有的Cu粉 | 加足量稀硫酸,过滤,洗涤,干燥 |
C | 鉴别NH4NO3和CO(NH2)2固体 | 分别取少量固体加入熟石灰研磨,闻气味 |
D | 鉴别Na2CO3和NaHCO3固体 | 滴加稀盐酸,观察有无气泡产生 |



①碲属于 (填“金属”或“非金属”)元素,其相对原子质量为 。
②碲元素化学性质与图中 元素化学性质相似。碲元素与13号元素形成的化 合物化学式为 。

①金属镍在化学反应前后 不变。
②反应的化学方程式为 ,从该化学方程式中你能获得的信息有 。



①铜、铁、铝在自然界中均主要以化合物的形式存在,但人类大量冶炼和使用金属铝的时间较晚,主要原因是(填字母)。
A.地壳中铝元素含量较低
B.铝较活泼,难以寻找到合适的物质将其从矿物中还原出来,冶炼技术要求高
②将未经砂纸打磨和打磨过的铝片同时放入盛有稀硫酸的同一烧杯中,发现一段时间内未经打磨的铝片表面没有明显现象,原因是;经打磨过的铝片表面有气泡产生,反应的化学方程式为。
金属硬度(以金刚石的硬度10作为标准) | 铬 铁 银 铜 金 铝 铅 |
(大)9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5(小) | |
地壳中金属元素含量 | 铝 铁 钾 镁 铬 铜 |
(高)7.73% 4.75% 2.47% 2.00% 1×10﹣2% 5×10﹣3%(低) | |
金属材料市场价格(万元/吨) | 银 铜 铬 铝 锌 铅 生铁 |
(高)496 6.87 6.6 2.276 2.267 1.43 0.485 (低) |
①实验开始前,应先检查 。
②装置中B和C的位置 (填“能”或“不能”)调换。
③Cu2(OH)x(CO3)y分解完全后需再通入一定量的N2 , 目的是 。
④B、C反应前后质量增加分别为m g和n g,则x:y=(用含m、n的代数式表示)。

滴入几滴酚酞溶液,溶液变红,说明氢氧化钠溶液pH 7(填“>”、“=”或“<”)。
将注射器中相同体积的NaOH溶液和水同时注入锥形瓶中,观察到 现象,说明氢氧化钠与二氧化碳发生了反应,反应的化学方程式为 。
查阅文献得知:①NaOH溶解于乙醇的速率较慢,20℃时其在乙醇中的溶解度为14g/100mL;②乙醇密度为0.8g/mL;③氯化钠难溶于乙醇。
20℃时,用小烧杯称取2.0gNaOH固体,加入50.0mL乙醇,用玻璃棒不断搅拌约20分钟,静置,烧杯底部有少量固体,此时上层清液为 (填“饱和”或“不饱和”)溶 液。20℃时,NaOH的乙醇饱和溶液中溶质质量分数为 (保留到0.1%)。
烧杯编号 | 乙醇体积:蒸馏水体积 | 溶解NaOH的质量/g |
① | 4:1 | 1.1 |
② | 3:1 | 1.4 |
③ | 1:1 | 3.1 |
分析上表数据,可得出的结论是 。
在上述三只烧杯中均加入10.0mL相同浓度HCl的乙醇溶液。搅拌并静置后,发现三只烧 杯中均有固体,说明氢氧化钠与盐酸发生了反应,且烧杯③中固体最少,主要原因是 。