 C .
C .  3-甲基-1-丁烯
D . “玉兔”号月球车的热源材料
3-甲基-1-丁烯
D . “玉兔”号月球车的热源材料选项 | 玻璃仪器 | 实验 |
A | 试管、胶头滴管 | 区分饱和 |
B | 胶头滴管、锥形瓶、滴定管用 | 标准 |
C | 导管、酒精灯、试管 | 用乙醇和乙酸制备乙酸乙酯 |
D | 烧杯、玻璃棒、容量瓶 | 用 |
A | B | C | D |
|
|
|
|
制备 | 灼烧海带 | 分离加入食盐后的蛋白质与水的混合物 | 排空气法收集 |

选项 | 实验操作及现象 | 结论 |
A | 将乙醇与浓硫酸的混合物加热至170℃,并将产生的气体干燥后再通入溴的水溶液中,溴的水溶液褪色 | 乙醇发生了消去反应 |
B | 向淀粉溶液中先加入稀硫酸并加热,再加入碘水,溶液变蓝 | 淀粉未发生水解 |
C | 取1.5g苯酚溶于适量乙醇中,再加入绿豆大小的吸干煤油的金属钠,有连续的气泡产生 | 钠与苯酚反应生成氢气 |
D | 将 |
|

 系统命名为:。
系统命名为:。
a. b.
![]() c.
c.![]()
①a与新制氢氧化铜反应的方程式:。
②c与浓硝酸反应生成TNT的方程式是:。
③向b滴浓溴水产生白色沉淀的方程式是:。
①若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为。
②若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为。若其苯环上的一溴代物只有一种,写出符合条件烃B的一种物质的结构简式。

粗品含少量难溶于水的杂质,纯化粗品的操作为:取烧杯加入10蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液,趁热减压过滤,除去不溶物,将滤液冷却至室温,加入10
95%溶液并搅拌促进晶体析出,待晶体充分析出后,减压过滤,在50℃下用恒温干燥箱烘干。
测定产品纯度:取mg提纯后的产品溶于水配制成100.00溶液,取25.00
置于锥形瓶中,向其中滴入少量
作为指示剂(遇
生成
),再加入过量的
无色溶液(遇
生成
),同时发生反应:
(酒红色)
(无色)
(蓝色)。再用
标准溶液滴定至终点.三次滴定平均消耗锌标准溶液
。
①滴定终点的现象为。
②该产品的纯度为。(用含m,、
,
、
的代数式表示)
①中
的配位数为。
②配体中心C原子的杂化方式为:。
③O、N、S三种元素的电负性由大到小的顺序为。

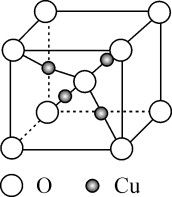
①该晶体中原子个数比为:。
②若晶胞参数分别为a、b
、c
, 阿伏加德罗常数的值为
, 则晶体的密度为
(列出计算表达式)。
 的合成路线。
的合成路线。