

①已知
, 则氢气的燃烧热
;
②单质A和单质B互为同素异形体,由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定;
③
, 恒温恒压条件下达到平衡后加入X,上述反应的
增大;
④根据下表数据可以计算出3H2+![]()
![]() 的焓变;
的焓变;
|
共价键 |
C-C |
|
C-H |
H-H |
|
键能/( |
348 |
610 |
413 |
436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1mol(g)时,放出的热量相等;
⑥25℃、101kPa时,1mol碳完全燃烧生成(g)所放出的热量为碳的燃烧热。

 是反应的催化剂
D .
是反应的催化剂
D . | | | | |
| 甲 | 乙 | 丙 | 丁 |
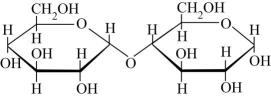

 互为同系物
B . 能使
互为同系物
B . 能使①![]() ②
②![]()
③![]() ④
④![]()
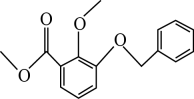
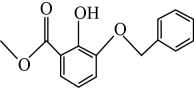
一定条件下①可以转化为④,下列试剂中能实现该转化的是____(填字母)。
A.分子中除苯环外不含其他环状结构
B.苯环上一氯代物有三种
C.能与溴水中的Br2按1∶4进行反应

已知:①
②有机物J结构中含两个环。
回答下列问题:
①官能团与苯环直接相连 ②苯环上有三个取代基 ③与溶液反应产生气泡
 的路线流程图:。
的路线流程图:。
①能发生银镜反应
②遇溶液发生显色反应
③核磁共振氢谱显示峰面积之比为6∶2∶1∶1
 , 设计合成路线:(无机物自选)。
, 设计合成路线:(无机物自选)。
 +HNO3
+HNO3 +H2O
+H2O
 +3H2
+3H2
 +2H2O
+2H2O
物质 | 相对分子质量 | 沸点/℃ | 密度g/mL | 溶解性 |
硝基苯 | 123 | 210.9 | 1.23 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚; 还原性强、易被氧化 |
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。

请回答下列问题:
实验装置中长玻璃管可以用代替(填仪器名称)。
①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。

②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140 ℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186 ℃馏分,得到较纯苯胺。
回答下列问题:
步骤②中温度计水银球的位置位于(填序号,下同),步骤⑥中位于。
A.烧瓶内反应液中
B.贴近烧瓶内液面处
C.三颈烧瓶出气口(等高线)附近