选项 | 实验目的 | 实验操作 |
A | 鉴别 O2和 N2 | 燃着的木条伸入 |
B | 鉴别食盐水和稀盐酸 | 加入酚酞试剂 |
C | 除去 CO2 中的 CO | 点燃混合气体 |
D | 除去 KCl 溶液中的 Na2SO4 | 加入氯化钡溶液 |

实验编号 | 药品 |
I | 块状大理石 10%H2SO4溶液 |
II | 块状大理石 7%HCl 溶液 |
Ⅲ | 大理石粉末 7%HCl 溶液 |

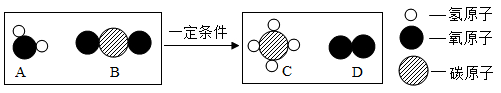
在该反应中,生成 C 和 D 的质量之比为。

C 试管中发生反应的化学方程式为;

对比甲、乙实验,说明(选填“NaOH”、“Ca(OH)2”)固体具有吸水性;
填写下表。
实验方案 | 实验步骤 | 现象和结论 |
1 | 取样,分别滴入几滴无色酚酞试液 | 变色的是碳酸钠溶液,不变色的是氯化钾溶液。 |
2 | 分别用铂丝蘸取两种溶液放在酒精灯火焰上灼烧。 |
现有一瓶含有杂质的氯化钠固体(可能含有碳酸钙、碳酸钠、硝酸钡、硫酸钾中的一种或几种),为了判定成分,做了以下实验,烧杯中的固体质量随加入的水或稀盐酸质量的变化情况如下图所示。

原氯化钠固体中一定含有的物质是;


Ⅰ、以上过程中,操作 a 是,产物中可作氮肥的是;
Ⅱ、经测定,以上反应中,参加反应的 NaCl 的物质的量为 1mol,20℃的固液混合物中,NaHCO3固体首先析出,而 NH4Cl 固体不析出,请结合相关数据分析说明 。