 D .
D .  B . 除去乙烯中的
B . 除去乙烯中的 C . 收集
C . 收集 D . 吸收尾气中的
D . 吸收尾气中的

已知:为强氧化剂,其中N元素为-3价。下列说法不正确的是( )

步骤1:在试管中加入0.5 g淀粉和4mL2
溶液,加热。
步骤2:待溶液冷却后向其中加入NaOH溶液,将溶液调至碱性。
步骤3:再向试管中加入少量新制的加热,观察到试管内出现砖红色沉淀。
下列分析不正确的是( )

实验 | 实验操作及现象 |
1 | 用pH传感器测定其pH约为8.47 |
2 | 向10mL0.5 |
3 | 向10mL0.5 |
4 | 向10mL0.5 |
下列有关说法正确的是( )


已知:
①25℃, ,
;
②和
均为能溶于水的强电解质。


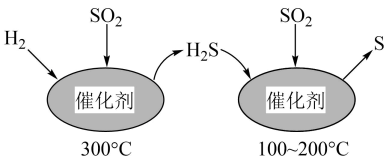
①在实验室模拟脱硫过程:调节吸收液的pH为5,向其中通入含
的模拟烟气。测得脱硫反应后,溶液中的阴离子为
和
, 则脱硫反应的离子方程式为。
②在实验室模拟脱硝过程:调节吸收液的pH为5,向其中通入含NO的模拟烟气。测得脱硝效率(即NO的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是。

③在实验室模拟同时脱硫、脱硝过程:调节吸收液的pH为5,向其中通入含
和NO(体积比4:1)的模拟烟气。测得脱硫反应速率大于脱硝反应速率,原因是除了
和NO在烟气中的初始浓度不同,还可能是。
Ⅰ.制备
方法(一)碱溶法
已知:①
②

