选项 | 化学反应方程式 | 已知条件 | 预测 |
A | A(s)=B(g)+C(s) | △H>0 | 它一定是非自发反应 |
B | A(g)+2B(g)=2C(g)+3D(g) | 能自发反应 | △H一定小于0 |
C | M(s)+aN(g)=2Q(g) | △H<0,自发反应 | a可能等于1、2、3 |
D | M(s)+N(g)=2Q(s) | 常温下,自发进行 | △H>0 |
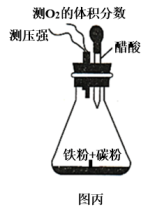
①N2O4的消耗速率与NO2的生成速率之比为1:2
②烧瓶内气体的颜色不再加深
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的密度不再变化
⑦烧瓶内气体的平均相对分子质量不再变化


相关反应的热化学方程式为:
反应I: SO2(g)+I2(g)+ 2H2O(1)= 2HI(aq)+H2SO4(aq) △H1 = -213kJ·mol-1
反应II: H2SO4(aq)= SO2(g)+H2O(1)+ O2(g) △H2 = +327 kJ·mol-1
反应III: 2HI(aq)=H2(g)+I2(g) △H3 = +172 kJ· mol-1
下列说法错误的是( )

下列推断正确的是( )

编号 | 化学方程式 | 平衡常数 | 温度 | |
979 K | 1173K | |||
I | Fe(s)+CO2(g)⇌FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
II | CO(g)+H2O(g)⇌CO2(g)+H2(g) | K2 | 1.62 | b |
III | Fe(s)+H2O(g)⇌FeO(s)+H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )


①N2(g)+2O2(g)=2NO2(g)△H = +68 kJ·mol-1
②N2H4(1)+3O2(g)=2NO2(g)+2H2O(l)△H=-622kJ·mol-1
③H2O(g)=H2O(l)△H=-44kJ·mol-1

已知分别破坏1molN≡N键、1molH-H键时需要吸收的能量为946kJ、436kJ,则破坏1molN-H键需要吸收的能量为kJ。现取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量92kJ(填“大于”等于”或“小于”),原因是。若加入催化剂,△H(填“变大”、“变小”或“不变”)。

某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G 点中的点;当压强为20MPa、温度为T2时的平衡常数Kp=MPa-1 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留2位有效数字)。

电池工作时,盐桥中的阴离子向极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向方向移动,此时C2极的电极反应式为。


a的电极反应式为。当有2molH+通过质子交换膜时,理论上电极a消耗葡萄糖的质量为g;该电池(填“能”或“不能”)在高温条件下使用。

反应A: CO2(g)+ 3H2(g) CH3OH(g)+H2O(g)
反应B: CO2(g)+ H2(g) CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。

①由图可知温度升高时CO的产率上升,其主要原因可能是。
②由图可知获取CH3OH最适宜的温度是。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有。
A.使用催化剂
B.增大体系压强
C.增大CO2和H2的初始投料比
D.投料比和容器体积不变,增加反应物的浓度
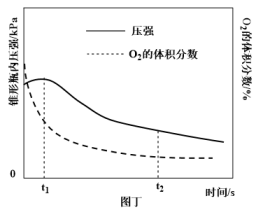
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
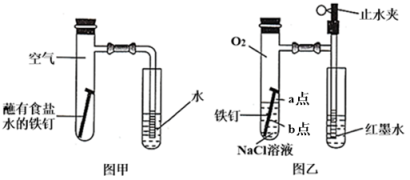
实验操作 | 实验现象 | 实验结论 |
向NaCl溶液中滴加2~3滴酚酞溶液 | a点附近溶液出现红色 | a点电极反应为 |
一段时间后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为Fe-2e-=Fe2+ |