
有些晶体按比例带有一定量的结晶水,带有结晶水的晶体在一定温度下会脱去结晶水.草酸晶体(H2C2O4•xH2O)在常温下是一种无色透明晶体.草酸晶体受热时分解的化学方程式为:
H2C2O4•xH2O(x+1)H2O+CO2↑+CO↑
某化学兴趣小组的同学利用该信息以及所学的知识设计并开展实验,测定草酸晶体中结晶水的质量分数.(图中固定装置已略去,装置气密性良好,装置A、B中的试剂足量,注射器量程足够)
Ⅰ.测量装置A、B的质量,排尽注射器中的空气,连接装置;
Ⅱ.取质量为m的草酸晶体,加热至完全分解,将产物全部通入以上装置;
Ⅲ.测量并记录装置A增加的质量为a,装置B增加的质量为b,装置C读数为V;
Ⅳ.甲、乙、丙三位同学分别利用装置A、B、C所得数据计算该草酸晶体中结晶水的质量分数.
请回答下列问题:
(1)装置A中盛放的液体是;装置B的作用是;装置C的作用之一是测量的体积.
(2)乙同学对利用装置B测量结果计算的可靠性经行反思与评价,认为反应后装置A中残留的气体会使自己的计算结果(填“偏小”或“偏大”).
(3)甲同学依据装置A测量结果计算结晶水的质量分数为 (用代数式表示).

有一包白色固体可能含碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某化学兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.

请回答下列问题:
(1)BC段可观察到的现象是 , 从C到D液体的pH(填“增大”、“减小”或“不变”);
(2)原白色固体中一定含有 , 可能含有;
(3)D点时,溶液中一定含有的溶质是;
(4)为进一步探究该白色固体的成分,该组同学取少量原固体样品于试管中,加足量水溶解,加 , 过滤;再向滤液中加 , 观察现象.
废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的实验流程如图(部分生成物已略):
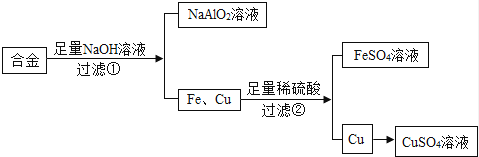
(1)合金属于 (填“纯净物”或“混合物”);
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R═2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为 ,步骤②反应的化学方程式为 ;
(3)由Cu制取CuSO4溶液有以下三种途径:
I.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O22CuO CuO+H2SO4═CuSO4+H2O
Ⅲ.3Cu+8HNO3═3Cu(NO3)+2NO↑+4H2O
你认为最佳途径是 (填序号),理由是 .
方案1:称量混合物A的总质量和干燥的沉淀B或CaCl2固体的质量,并进行计算;
方案2:称量混合物A的总质量和实验改进后所得纯净氯化钠固体的质量,并进行计算。
请你判断:上述所选称量数据不合理的是(填:“方案1”或“方案2”)。
理由是。
第一小组同学为检验某CO2气体中是否混有CO和H2 , 设计了如下的实验装置:
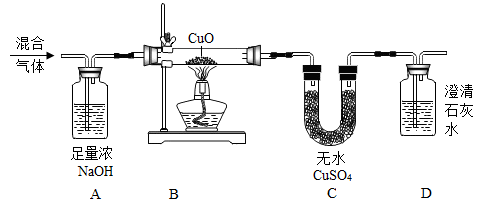
请回答:
①A装置中发生反应的化学方程式是。
②实验过程中观察到C装置变蓝色,小冯同学由此判断气体中一定混有H2 , 小汪同学认为不对,理由是。
硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯钾肥.如图1是硫酸铵等几种盐的溶解度曲线.回答下列问题:

① ;②温度相同时, .
③根据溶解度曲线判断产品(无氯钾肥)的化学式是 ;
④操作Ⅰ主要是趁热过滤,过滤后的产品中 (NH4)2SO4晶体析出(填“有”或“没有”).
资料:苯酸钾熔点122.4℃;纯净固体一般都有固定熔点;在常温时苯酸钾溶解度很小.小于0.4g.
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜 想】猜想1:苯酸钾;猜想2:氯化钾,猜想3: .
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸.
实验操作 | 实验现象 | 实验结论 |
Ⅰ将白色固体A加入水中,加热、溶解、冷却、过滤. | 得到白色晶体和无色滤液 | |
Ⅱ取无色滤液少许于试管中, |
| 白色固体A中含有KCl |
Ⅲ取白色晶体, | 熔点是 | 结合实验Ⅱ,猜想3成立 |