



物质 | NaOH | Ca(OH)2 | CaCO3 | CaSO3 |
溶解度(克) | 109 | 0.165 | 0.0014 | 0.0043 |
①实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明。
②20℃时,饱和氢氧化钠溶液的溶质质量分数为(精确到 0.1%) 。
氮是空气中含量最多的元素,也是构成生物体的必要元素之一。但是,空气中游离态的氮不能直接被大多数生物所利用,必须经过变化,并与其他成分形成化合物(如氨或铵盐等),才能被植物利用。
① 2022 年北京冬奥会,国家速滑馆“冰丝带”采用当前最先进的 CO2跨临界直冷制冰技术,可实现 CO2循环利用和碳排放几乎为零,CO2气体制成干冰时,从微观角度看,发生改变的是。
②2021 年 9 月 24 日,《科学》在线发表了我国科研人员在国际上首次实现了二氧化碳到淀粉的从头合成。请分析“搭积木”式的合成路线图,回答有关问题。

在自然界中绿色植物可以通过 将二氧化碳转化为淀粉。食物中的淀粉[(C6H10O5)n在淀粉酶和水的作用下转化为葡萄糖,葡糖糖在体内缓慢氧化转化为 CO2和 H2O,该转化中消耗 O2与产生的 H2O 分子个数比为。
③写出上图中①中反应生成甲醇(CH3OH)和水的化学方程式。
④为达成“2030 年前实现碳达峰”的目标,下列措施不可行的是。
A.开发新能源 B.植树造林 C.禁止使用化石燃料

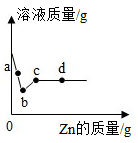
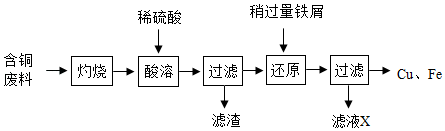
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
下列关于该流程的说法,错误的是____。



A.提出问题 B.做出假设 C.进行实验 D.获得结论
打开 K2、关闭 K1 , 利用①、③装置来验证产生的气体中含水蒸气,此时仪器甲中盛放的物质是,可以观察到的现象是。
实验过程中观察到的现象为。对反应后的固体残渣(二氧化锰)进行回收再次利用,你认为固体残渣能进行回收再次利用的原因是。

【查阅资料】①溶液 pH 大于 8.8 时,Fe2+完全转化为 Fe(OH)2沉淀;
②FeCO3固体置于潮湿空气中易变质生成 Fe(OH)3
③FeCl3溶液中滴加 KSCN 溶液,会出现血红色絮状物;而 FeCl2溶液中滴加 KSCN 溶液,不会出现血红色絮状物
④FeCO3是白色固体,难溶于水,能与酸反应,与稀盐酸反应的化学方程式为
⑤碱石灰的主要成分是 NaOH 和 CaO
该兴趣小组用 pH=11.9 的 Na2CO3溶液和 FeSO4溶液在烧杯中制备 FeCO3时,应选用的加料方式是____(填字母)。
【提出问题】久置于空气中的 FeCO3固体的成分是什么?
【猜想与假设】猜想 1:FeCO3 猜想2:Fe(OH)3 猜想 3:
【实验结论】久置于空气中的 FeCO3固体的成分是 FeCO3和 Fe(OH)3。
①该兴趣小组为进一步确定固体中 FeCO3的质量分数,称取10.0g 固体做了如下图所示的补充实验。

装置 C 中足量 NaOH 溶液的作用是(用化学方程式表示)
②反应结束后,继续通入一段时间 N2的目的是。如果去掉装置 D,实验结果(“偏大”“减小”“不变”)
③实验结束后,测得装置 C 增重 0.44g,求固体中 FeCO3的质量分数。(写出必要的计算过程)