 C . K+离子的结构示意图:
C . K+离子的结构示意图: D . 二氧化碳的电子式:
D . 二氧化碳的电子式:①理论上1mol苯和1mol甲苯均能与3molH2发生加成反应;
②用灼烧的方法可以区别蚕丝和棉花;
③油脂水解可得到氨基酸和甘油;
④纤维素和淀粉都是多糖,二者互为同分异构体;
⑤多糖和蛋白质在一定条件下都能水解;
⑥乙醇中是否含水,可用金属钠来检测


选项 | 操作 | 现象 | 结论 |
A | 往蓝色石蕊试纸上滴几滴新制饱和氯水 | 试纸先变红后褪色 | 新制氯水既有酸性,又有漂白性 |
B | 向CaCl2溶液中通入少量CO2 | 溶液中出现白色沉淀 | Ca2+与 |
C | 取少量NH4Cl固体于试管底部,加热试管底部 | 试管口处有晶体出现 | NH4Cl易升华 |
D | 往少量酸性KMnO4溶液中通入SO2 | 溶液褪色 | SO2有漂白性 |



仪器A的名称为。

实验步骤:
①打开K1、K2和K3 , 关闭K4 , 缓缓通入干燥的N2;
②数分钟后关闭K1、K3 , 打开K4 , 点燃酒精喷灯(酒精喷灯灯焰温度可达1000℃),加热A中样品;
③一段时间后,熄灭酒精喷灯,打开K1 , 通入N2数分钟后关闭K1和K2 , 冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
装置B中的试剂为(写名称)。
一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
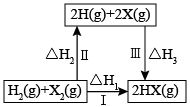
已知:①
②
则
=。


①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“
”或“
”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变
A.离子键 B.金属键 C.氢键 D.配位键


已知:①+2R'OH→2ROH+
;
②C为能与金属钠反应的芳香族化合物。
回答下列问题:
a.易溶于水b.分子中所有原子可能在同一平面
c.与乙醇互为同系物d.在一定条件下能发生消去反应生成乙炔
i.含有苯环;
ii.加入FeCl3溶液显紫色;
iii.核磁共振氢谱有5组峰,峰面积之比为。