






分析实验过程并完成以下问题:
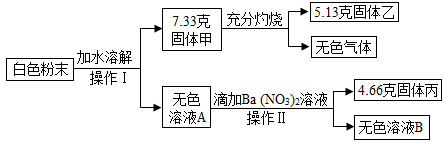
①取一定质量的粉末,加足量的水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀盐酸,得到无色气体和黄色溶液;
③将①步得到的无色溶液A进行如图所示的实验。
请回答下列问题:

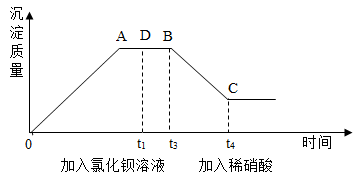
猜想1:可能是因为硫酸根离子引起的显色。
猜想2:可能是因为引起的显色。
猜想3:可能是因为水分子引起的显色。
请判断并说明理由。

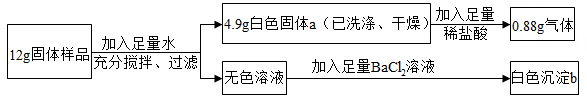
【提出问题】①氢氧化钠是否完全变质?②样品中氢氧化钠的质量分数是多少?
【查阅资料】①氢氧化钠与二氧化碳反应生成碳酸钠和水;
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应。
取少量该固体样品溶于水配成溶液,滴加足量的(填“Ca(OH)2溶液”或“CaCl2溶液”),观察到的现象,充分反应后过滤,向滤液中滴入少量的欲试液,观察到的现象,说明氢氧化的固体部分变质。
实验二:测定样品中氢氧化钠的质量分数
②计算过程:解:设样器中碳酸钠的质量为x
|
Na2CO3+2HCl=2NaCl+ |
CO2↑+H2O |
|
106 |
44 |
|
x |
4.4g |
x=10.6g
样品中氢氧化钠的质量分数= x100%=35.4%
【交流与反思】在交流时,老师问同学们“能否用上述实验所得的数据准确计算出样品中氢氧化钠的质量分数”,但小科分析后,认为久置的氢氧化钠固体会因吸水而潮解,所以方案一中测得样品中氢氧化钠的质量分数结果(填“偏大”或“偏小”)。