CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH= -890.3 kJ·mol-1
①4Fe(s)+3O2(g)= 2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)= 2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)= Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是( )
①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B物质的量浓度

| A | B | C | D |
| | | | |
| 2SO2(g)+O2(g)⇌2SO3(g) ∆H=-akJ/mol | N2(g)+3H2(g) ⇌2NH3(g) ∆H=-bkJ/mol | N2O4(g)⇌2NO2(g) ∆H=+ckJ/mol | CO2(g)+C(s) ⇌2CO(g) ∆H=+dkJ/mol |

|
共价键 |
N- H |
N- N |
O= O |
O-H |
|
|
键能/( kJ·mol-1 ) |
391 |
161 |
498 |
463 |
|
|
热化学方程式 |
N2H4(g) +O2(g)=N2(g) + 2H2O(g) |
ΔH=- 570kJ·mol-1 |
|||


理想气体的自发混合
起始量 | 甲 | 乙 | 丙 |
H2(mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |

|
选项 |
实验操作 |
现象 |
解释或结论 |
|
① |
分别在20℃、30℃下,取0.1mol·L-1KI溶液,向其中先加入0.1mol·L-1的硫酸溶液,再加入 淀粉溶液,发生反应4H++O2+4I-=2I2+2H2O |
30℃下出现蓝色的时间短 |
探究反应速率与温度的关系 |
|
② |
向FeCl3和KSCN的混合溶液中,加入KCl固体 |
溶液颜色不变 |
其他条件不变时,增大Cl的浓度,平衡不移动 |
|
③ |
两支试管各盛0.1mol/L4mL酸性高锰酸钾溶液,分别加入0.1mol/L2mL草酸溶液和0.2mol/L2mL 草酸溶液 |
加入0.2mol/L草酸溶液试管中,高锰酸钾溶液褪色更快 |
其他条件不变时,反应物浓度越大,反应速率越快 |
|
④ |
把充有NO2和N2O4的平衡球装置分别放入热水和冷水装置中(2NO2 |
热水中颜色更深 |
其他条件不变时,温度升高,平衡向吸热反应方向移动 |



|
实验次数 |
起始温度 t1 /℃ |
终止温度 t2 /℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |

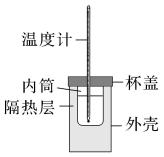
除如图装置所示的实验用品外,还需要的一件实验用品是
乙同学利用浊度计探究一定条件下反应物浓度对硫代硫酸钠(Na2S2O3)溶液与硫酸溶液反应速率的影响。
已知:浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到相同浑浊度的过程中,浑浊度随时间的变化。实验①~⑤所得数据如图2曲线①~⑤所示。

|
实验装置 |
Na2S2O3溶液 |
H2SO4溶液 |
蒸馏水 |
||
|
c /mol·L-1 |
V / mL |
c /mol·L-1 |
V / mL |
V / mL |
|
|
① |
0.1 |
1.5 |
0.1 |
3.5 |
10 |
|
② |
0.1 |
2.5 |
0.1 |
3.5 |
9 |
|
③ |
0.1 |
3.5 |
0.1 |
3.5 |
x |
|
④ |
0.1 |
3.5 |
0.1 |
2.5 |
9 |
|
⑤ |
0.1 |
3.5 |
0.1 |
1.5 |
10 |
【分析与解释】
实验③中,x=。
反应②:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH2 = –122.5 kJ·mol-1


①上图中表示在恒压条件下进行反应的曲线是(填“a”或“b"”)。
②t=250℃时,改变压强达到平衡时x(CH3OH)=0.05,CO2的平衡转化率α= %(保留三位有效数字)
下列能说明该反应已达到平衡状态的是____ (填序号)。
