一、单选题(共10个小题,每题只有一个正确答案,每题2分,共20分)
-
A . Na2O2、Fe2O3、Al2O3均为碱性氧化物
B . 液氯为纯净物、氯水为混合物
C . 烧碱、纯碱、盐酸均为电解质
D . 稀豆浆、淀粉溶液、氯化铁溶液均为胶体
-
A . 正丁烷的结构简式: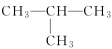 B . 丙烷分子的空间填充模型:
B . 丙烷分子的空间填充模型: C . 甲烷分子的球棍模型:
C . 甲烷分子的球棍模型: D . 羟基的电子式:
D . 羟基的电子式:
-
A . 标准状况下,11.2LH2O中含有分子的数目为0.5NA
B . 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
C . 标准状况下,22.4LN2和H2的混合气体中,原子总数为2NA
D . 1molFe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA
-
A . 盐酸滴入氢氧化铜中:H++OH-=H2O
B . 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
C . 实验室用大理石和稀盐酸制取CO2:2H++CO =CO2↑+H2O
D . 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
=CO2↑+H2O
D . 碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
-
A . 无色透明的溶液中:Cu2+、K+、SO 、NO
、NO B . 使无色酚酞试液呈红色的溶液中:Na+、K+、SO
B . 使无色酚酞试液呈红色的溶液中:Na+、K+、SO 、CO
、CO C . BaCl2溶液中:K+、OH-、SO
C . BaCl2溶液中:K+、OH-、SO 、Cl-
D . pH=1的溶液中:Na+、K+、CO
、Cl-
D . pH=1的溶液中:Na+、K+、CO 、NO
、NO
-
6.
(2022高三上·微山月考)
压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H
2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
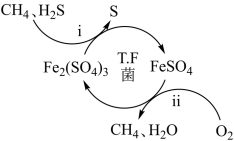
A . Fe2(SO4)3可以视为该脱硫过程中的催化剂
B . 该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
C . 该脱硫过程不能在高温下进行
D . 该脱硫过程是将H2S转化为FeSO4
-
7.
(2022高三上·微山月考)
下列除杂试剂选用正确且除杂过程
不涉及氧化还原反应的是( )
| 物质(括号内为杂质) | 除杂试剂 |
A | FeCl2溶液(FeCl3) | Fe粉 |
B | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
C | Cl2(HCl) | H2O、浓H2SO4 |
D | CuCl2(FeCl3) | 氨水 |
A . A
B . B
C . C
D . D
-
A . 用氯化钡溶液检验 是否变质
B . 用湿润的红色石蕊试纸检验溶液中是否有
是否变质
B . 用湿润的红色石蕊试纸检验溶液中是否有 C . 用澄清石灰水来检验碳酸氢钠是否完全分解
D . 用焰色试验来检验碳酸钾中是否含有钠元素
C . 用澄清石灰水来检验碳酸氢钠是否完全分解
D . 用焰色试验来检验碳酸钾中是否含有钠元素
-
A . 石灰石、纯碱、玻璃都属于盐,都能与盐酸反应
B . 电解熔融Al2O3冶炼Al时加了冰晶石
C . 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
D . 在制粗硅的反应中,还原剂与氧化剂的物质的量之比为1:1
-
A . 铁与高温水蒸气的反应可实现上述转化①
B . FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C . 加热 发生转化⑥,加水溶解可实现转化③
D . 由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成
发生转化⑥,加水溶解可实现转化③
D . 由图可预测:高铁酸盐具有强氧化性,可用于消毒;消毒后可生成 胶体,故可作净水剂
胶体,故可作净水剂
二、不定项选择题(共5小题,每题有1-2个正确答案,每题4分,少选2分,选错不得分,共20分)
-
-
12.
(2022高三上·微山月考)
FeCl
3易潮解、易升华,实验室制备FeCl
3的装置如图所示(加热和夹持装置已略去)。下列说法不正确的是( )

A . 导管g的作用是平衡气压,便于液体滴下
B . 试剂X和试剂Y分别为饱和食盐水、浓硫酸
C . 直接用E接收产物比用导管连接D,E的优点是可防止堵塞
D . 出于简化装置的目的,F装置可拆除
-
A . 图1证明过氧化钠与水反应放热
B . 图2实验室制备氨气
C . 图3比较碳酸钠和碳酸氢钠的热稳定性
D . 图4制备Fe(OH)2并能较长时间观察其颜色
-
14.
(2022高三上·微山月考)
以硫酸渣(含Fe
2O
3、SiO
2等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示。

下列说法正确的是( )
A . “酸溶”中适当增大硫酸浓度可加快溶解
B . “过滤I”所得滤渣成分为SiO2
C . “沉铁”生成的气体为CO2
D . “氧化”过程中用空气代替NaNO2溶液可加快氧化速率
-
15.
(2022高三上·微山月考)
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
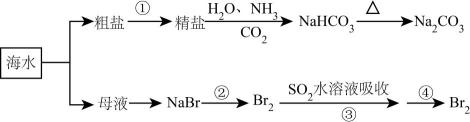
A . 在第②③④步骤中,溴元素均被氧化
B . 侯氏制碱过程中应先通CO2再通NH3
C . 制取NaHCO3的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
三、非选择题(共5小题,60分。除标注外每空2分)
-
-
(1)
Ⅰ、铝土矿(主要成分为Al
2O
3 , 含有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
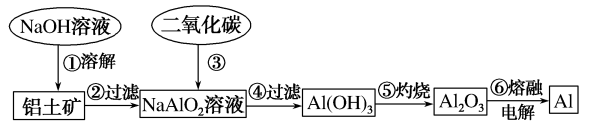
请用离子方程式表示以上工艺流程中第①步反应:。
-
(2)
写出以上工艺流程中第③步反应的化学方程式:。
-
(3)
若第①步加入的是盐酸,则发生反应的离子方程式为。
-
(4)
Ⅱ、下图为几种物质的转化关系,其中A为金属,B为淡黄色固体粉末,每一物质均含有A元素。

写出下列物质的化学式:
B, C, E, F。
-
(5)
写出下列各步反应的化学方程式:
C→E;
F→C。
-
-
-
(2)
高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO
4+16HBr=5Br
2+2MnBr
2+2KBr+8H
2O。
①其中元素被氧化(填化学式,下同),作氧化剂。
②在参加反应的HBr中,起还原剂(被氧化)作用的HBr与起酸性作用的HBr的质量之比为。
-
-
(1)
高纯度单晶硅是典型的无机非金属材料,它的发现和使用曾引起计算机的一场“革命”。下列有关硅材料的说法正确的是____(填字母)。
A . 晶体硅用于制作半导体材料
B . 硅在常温下化学性比较活泼
C . 玻璃属于硅酸盐材料
D . 玛瑙的主要成分是硅单质
-
(2)
工业上常用金属钠冶炼钛,是利用金属钠的强性。
-
(3)
常温下,可用铁或铝制器皿盛放浓硝酸,是因为。
-
(4)
纯碱和小苏打均为常见的厨房用品。兴趣小组同学用如图装置比较纯碱(Na
2CO
3)和小苏打(NaHCO
3)的热稳定性。实验过程中可以观察到烧杯
(填“I”或“II”)中澄清石灰水变浑浊。加热后试管中发生反应的化学方程式为
。

-
(5)
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。配平该方程式。
-
19.
(2022高三上·微山月考)
现有一定量含有Na
2O杂质的Na
2O
2试样,用如图的实验装置测定Na
2O
2试样的纯度。(可供选用的反应物只有CaCO
3固体、稀盐酸、稀硫酸和蒸馏水)
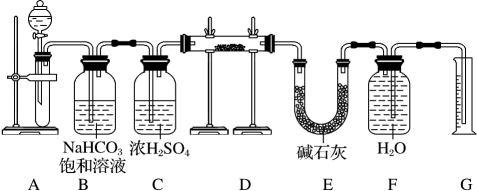
回答下列问题:
-
(1)
装置A中液体试剂选用稀盐酸而不选用稀硫酸,理由是。
-
-
-
(4)
若开始时测得样品的质量为2.0g,反应结束后测得气体体积为250mL,该条件下此气体密度为0.00128g/mL。则Na2O2试样的纯度为。
-
(5)
现有7.8Na2O2 , 试计算完全与CO2反应转移的电子数目。
-
20.
(2021高一上·大兴期末)
长期放置的FeSO
4溶液易被氧化而变质。某兴趣小组分别对新制和久置的两瓶FeSO
4溶液进行了如表实验。
-
(1)
I.分别取2mL新制的FeSO
4溶液于三支试管中,进行如图实验。

| 实验 | 试剂X | 实验现象 |
实验i | 1mL1mol/LNaOH溶液 | 现象a |
实验ii | 5滴酸性KMnO4溶液 | 现象b:紫色褪去 |
实验iii | 依次加入5滴KSCN溶液、5滴氯水 | 现象c |
方案i中,现象a是立即产生白色沉淀,白色沉淀逐渐变为灰绿色,最终变为红褐色。白色沉淀的化学式是,最终变为红褐色的化学方程式是。
-
(2)
方案iii的实验现象是,写出氯水参与反应的的离子方程式:。
-
(3)
II.久置的FeSO
4溶液。
实验操作 | 实验现象 | 实验结论 |
实验iv | 取少量久置的FeSO4溶液于试管中,向其中滴加5滴KSCN溶液 | 溶液变红 | FeSO4溶液部分变质 |
实验v | | |
将上述实验v中的实验操作和现象补充完整。
-
(4)
若要使部分变质的FeSO4复原,发生反应的离子反应方程式是。
-
(5)
小组同学查阅资料得知,“维生素C可将Fe
3+转化为Fe
2+”。为了验证维生素C的作用,设计了如表实验vi。
实验操作 | 实验现象 |
实验vi | 取一定量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性KMnO4溶液 | 紫色褪去 |
由实验vi能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由。


 B .
B .  D .
D . 







