


①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol;
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol;
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
下列判断错误的是( )


①酸式滴定管水洗后未用盐酸标准溶液润洗。
②滴定到达终点时,俯视读出滴定管读数。
③锥形瓶用水洗涤后未干燥,直接装待测液。
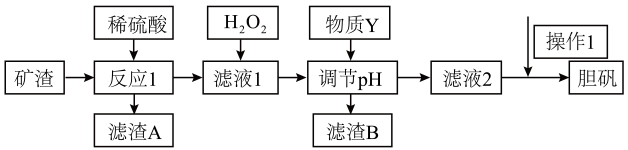
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH (室温 )
Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | |
开始沉淀的pH | 5.4 | 2.7 | 5.8 |
沉淀完全的pH | 6.7 | 3.7 | 8.8 |
A. NaOH B. HCl C. CuO D. NH3·H2O
②根据表格信息,调节pH值的范围是。
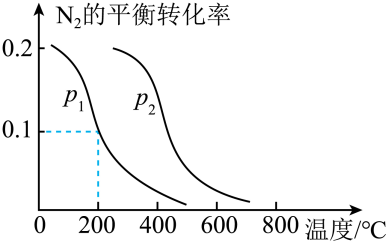
在恒温固定容积的反应室中,能说明上述反应达到平衡状态的是____。

电池正极发生的电极反应式是
弱酸 | HCOOH | HClO | H2CO3 | CH3COOH |
电离平衡常数 | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka=1.75×10 -5 |