
序号 | ① | ② | ③ | ④ |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钾溶液 | 醋酸 | 盐酸 |
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中正确的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2 )/mol | n(H2 )/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
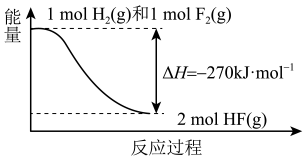
用离子方程式表示该反应的原理:。
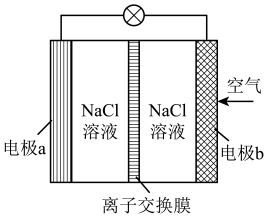
实验装置如图所示,实验时分液漏斗中A溶液一次性加入,A、B的成分见下表:

序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/LH2C2O4 (aq) | 4 mL 0.01 mol/L KMnO4(aq) |
② | 2 mL 0. 2 mol/LH2C2O4 (aq) | 4 mL 0.01 mol/L KMnO4(aq) |
③ | 2 mL 0. 2 mol/LH2C2O4 (aq) | 4 mL 0.01 mol/L KMnO4(aq) + MnSO4(少量) |
实验时使用下列各组试剂中合理的一组是____(填字母)。
化学式 | CH3COOH | H2CO3 | HClO |
Ka1 | 1.8 ×10-5 | 4.3 ×10-7 | 3.0 ×10-8 |
Ka2 | — | 5.6 ×10-11 | — |
下列四种离子结合H+能力最强的是 (填字 母)。
A. HCO B. CO
C. ClO- D. CH3COO-
写出HClO+Na2CO3 (少量)反应离子方程式:。
共价键 | C-H | O=O | H- O |
键能/(kJ·mol-1) | 413 | 498 | 464 |
热化学方程式 | H2O(l)=H2O(g) ΔH =+44kJ·mol-1 | ||
求算C=O的键能:。

该流程中第I步反应为CH4(g)+H2O(g) CO(g)+3H2(g) ΔH >0。 若下图表示在其他条件相同时,分别测定不同压强、不同温度下CH4的平衡转化率(纵坐标为CH4的平衡转化率),则p1 p2(填“>”或“<”)。

温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应的正反应是(填“吸”或“放”)热反应。
②在500 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为3 mol,则达到平衡后CO的转化率为。
实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
甲 | 2 | 5 | 4 | 3 |
乙 | 3 | 3 | 2 | 2 |
丙 | 0.25 | 4 | 2 | 1 |
③在830 ℃时,以上表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向逆反应方向进行的有(填实验编号)。
④在一个不传热的固定容积的容器中,判断该反应达到平衡的标志是 (填字母)。
A.各组分的物质的量浓度不再改变;
B. v(CO2)正=v(H2O)逆;
C.混合气体的密度不变;
D.混合气体的平均相对分子质量不变;
E.体系的压强不再发生变化;
F.体系的温度不再发生变化。
⑤如图表示该反应在t1时刻达到平衡,在t2时刻分别因改变某个 条件而发生变化的情况:图中t2时刻发生改变的条件可能是(写出两种)。
