
 D .
D . 

选项 | 实验设计或应用 | 离子方程式 |
A | 用氢氧化钠溶液除去镁粉中的杂质铝 | 2Al+2OH-+H2O=2AlO |
B | 用FeCl3溶液腐蚀铜线路板 | Cu+Fe3+=Cu2++Fe2+ |
C | 盛NaOH溶液的试剂瓶不能用玻璃塞 | 2OH-+SiO2=H2SiO3↓ |
D | 用饱和碳酸氢钠溶液除去CO2气体中混有的少量HCl | HCO |


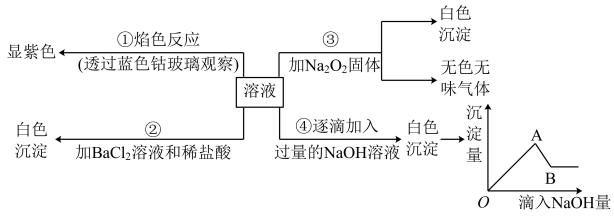
回答下列问题:
[查阅资料]硫酸亚铁的分解产物是一种碱性氧化物、一种酸性氧化物和SO3。

取少量A中红色粉末于试管中,加入稀硫酸使其溶解,向溶液中滴加(填化学式)溶液,根据现象判断该红色粉末为Fe2O3。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.BaCl2溶液
①称取上述样品9.0g,溶于适量的稀硫酸中,配成250mL溶液;
②准确量取25.00mL该溶液于锥形瓶中,用0.02000mol•L-1的KMnO4溶液与之完全反应,消耗KMnO4溶液30.00mL(杂质不与KMnO4溶液反应)。
实验室配制FeSO4溶液时,需加入少量Fe粉,目的是(用离子方程式表示)。
[查阅资料]
①常温下:16HCl(浓)+2KMnO4=2MnCl2+81H2O+2KCl+5Cl2↑;
②苯为有机物,密度比水小且不溶于水;
③氯、溴、碘的单质均易溶于有机溶剂。

仪器a的名称为。
为验证“84”消毒液的某些性质,实验小组设计图2实验方案。观察到试管1中溶液不褪色;试管2中溶液变蓝,短时间内无明显现象;试管3中溶液先变蓝,通入CO2后,溶液快速褪色。
①试管1的作用是。
②由试管2、3的现象可得到的结论是。
③若将试管3中通入的CO2换成盐酸也可达到相同的效果,且速度更快,但有可能产生Cl2而带来不良的实验后果,试用离子方程式解释产生Cl2的原因。

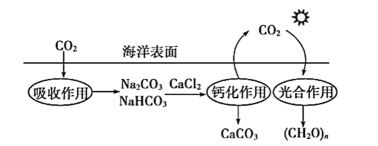
上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是;“滤渣”可循环使用,“滤渣”的主要成分是(填化学式)。

已知:HNO2为弱酸,在书写离子方程式时不能拆。
实验室制取NH3的化学方程式为。