 B . 苹果汁(pH:3~4)
B . 苹果汁(pH:3~4)  C . 西瓜汁(pH:5~6)
C . 西瓜汁(pH:5~6)  D . 玉米汁(pH:7~8)
D . 玉米汁(pH:7~8) 

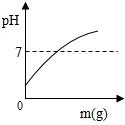 B .
B . 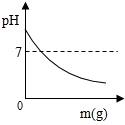 C .
C .  D .
D . 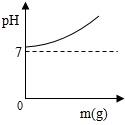

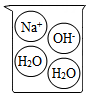 B .
B . 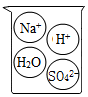 C .
C . 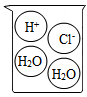 D .
D . 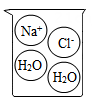
B .
B . 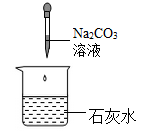
C .
C . 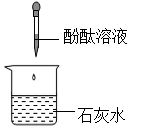
D .
D . 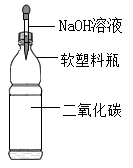
![]()



|
液体 |
雨水 |
糖水 |
厨房清洁剂 |
厕所清洁剂 |
|
pH |
5.6 |
7 |
11.8 |
2 |



[提出问题]气泡是怎么产生的?
[猜想假设]猜想1:;猜想2:铁与水反应;猜想3:铁锈与水反应。
[实验过程]为了验证假设,某同学设计了如图甲所示的实验方案进行探究。

|
甲 |
现象 |
结论 |
|
试管1 |
有气泡产生 |
猜想(1)正确 |
|
试管2 |
|
[反思]
⑴有同学认为上述实验不够严谨,于是他们又设计了如图乙的对照实验,这样设计实验的目的是: 。
⑵还有同学想:气体会不会是铁锈与水反应产生的?他认为还要补充一个铁锈与水反应的实验,你觉得有没有必要?(选填“有必要”或“没有必要”)。


|
步骤 |
实验操作 |
实验现象 |
|
① |
用干燥洁净的玻璃棒蘸取试剂滴在pH试纸上,显示的颜色与标准比色卡对照 |
pH=7 |
|
② |
另取5毫升试剂于B试管中,滴入几滴氯化钡溶液 |
溶液中出现白色沉淀 |
①根据步骤①现象,小科得出了该试剂不可能为。
②由步骤①②可确定该试剂为溶液。
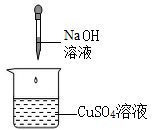
在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是。反应后溶液中一定含有的离子是(不考虑酚酞)。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。
但有的同学不赞同,理由是(装置气密性良好,稀盐酸挥发忽略不计);他认为仍利用此装置,再补充一个实验才能达成实验2目的,实验需要的试剂及用量为。
[对固体猜想]猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3混合物。
[实验和推断]



|
项目 |
亚硝酸钠 |
氯化钠 |
|
溶解性 |
15℃时溶解度为81.5g |
15℃时溶解度为35.8g |
|
熔点 |
271℃ |
801C |
|
水溶液酸碱性 |
碱性 |
中性 |
|
跟稀盐酸作用 |
放出红棕色气体NO2 |
无现象 |
|
跟硝酸银溶液作用 |
生成白色沉淀 |
生成白色沉淀 |

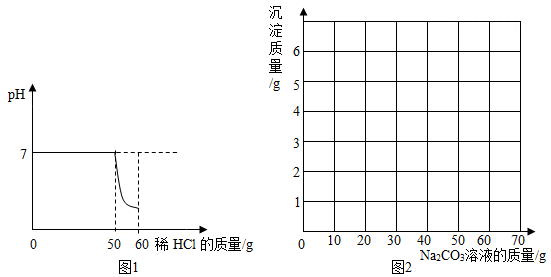
|
Na2CO3溶液质量/g |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
沉淀质量/g |
0 |
1 |
n |
3 |
4 |
5 |
m |
则m=。加入10gNa2CO3溶液时发生反应的化学方程式是。