 D . 中子数为18的氯原子:
D . 中子数为18的氯原子:
|
|
|
|
A.收集 | B. | C. | D.制备 |

选项 | 实验 | 玻璃仪器 | 试剂 |
A | 食盐精制 | 漏斗、烧杯、玻璃棒 | 粗食盐水、稀盐酸、 |
B | 比较 | 蒸馏烧瓶、分液漏斗、试管、导管 | 稀硫酸、碳酸钠固体、硅酸钠溶液 |
C | 喷泉实验 | 圆底烧瓶、胶头滴管、烧杯 |
|
D | 除去 | 烧杯、玻璃棒、胶头滴管 | 溴水、 |
阳离子 | 阴离子 |
已知在酸性溶液中会发生歧化反应。请回答下列问题:

①铜粉参与的反应中,氧化产物是(填离子符号)。
②当时,向溶液Q中通入氯气时发生反应的离子方程式为;假设不考虑
与
的反应,则根据实验现象可推算出V的范围为
。


①制备时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是。
②制备时,向FeSO4溶液中加入过量的
溶液,该反应的离子方程式为;铁红的化学式为。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、、洗涤、干燥得到产品。
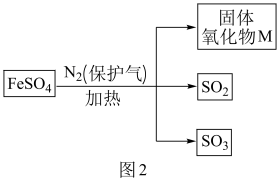
①关于M的成分提出三种猜想:
猜想1:M是;
猜想2:M是;
猜想3:M是和
。
②已知三种气体的部分性质如表所示:
物质 | |||
熔点/℃ | 16.8 | ||
沸点/℃ | 44.8 |
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在?(填“能”或“否”)。C中试剂可能是。

已知:①实验室制备原理为。
②资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
76.1 | 137.5 | 遇水剧烈水解,易与 | ||
1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于 | |
78.8 | 119 | 遇水剧烈水解,受热易分解 |

a仪器的名称为,b装置的作用是。

①准确称量称量瓶和盖的总质量 , 迅速加入
样品,立即盖紧,称量,质量为
。
②连同称量瓶一起放入盛有溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取溶液M于
碘量瓶中,加入两滴指示剂,用
的盐酸中和过量的
溶液至恰好完全。
④准确加入碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
的
溶液滴定过量的碘,反应为
。平行测定两次,反应消耗
溶液的平均体积为
。
判断滴定终点的方法为,样品中SOCl2的质量分数为;下列情况会导致测定的SOCl2的质量分数偏高的是(填标号)。
A.实际碘标准溶液浓度偏低
B.实际溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
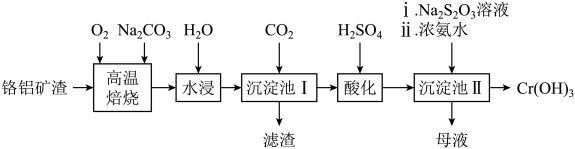
已知:①“高温焙烧”可以使矿渣转化为可溶性盐。
②酸性条件下,能稳定存在。