
![]()


 B .
B .  C .
C .  D .
D . 
第一步:2NON2O2 快速平衡【其速率方程为v正=k正c2(NO);v逆=k逆c(N2O2)】
第二步:N2O2+H2N2O+H2O 慢反应
第三步:N2O+H2=N2+H2O 快反应
其中可看似认为第二步反应不能影响第一步平衡,下列说法错误的是( )


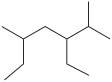 的名称为2,5-二甲基-3-乙基庚烷
B .
的名称为2,5-二甲基-3-乙基庚烷
B . 
序号 | 实验操作 | 实验现象 |
Ⅰ | 取20mL“84”消毒液和40mL医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
结论一:“84”消毒液能与酒精发生化学反应,二者不能混合使用。
结论二:该反应为放热反应。
乙同学认为要得出结论二还需补充两个实验,请简要写出实验方案。
实验Ⅱ:;
实验Ⅲ:。
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合。反应生成MnO(OH)2 , 实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+ , 在暗处静置5min,然后用标准Na2S2O3 , 溶液滴定生成的I2(2S2O+I2=2I-+S4O
)回答下列问题:
步骤Ⅰ中发生反应的化学方程式为。
物质 | H2(g) | O2(g) | H2O(g) | H2O(l) |
相对能量(kJ·mol-1) | 0 | 0 | -242 | -286 |
①表示H2(g)燃烧热的热化学方程为。
②0.5molH2O(g)转化为H2O(l)需要(填“吸收”或“放出”)kJ的热量。
Ⅰ.2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
Ⅱ.C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
根据盖斯定律计算CO(g)+O2(g)=CO2(g) △H=kJ·mol-1。
第一步:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0
第二步:CO(g)+H2O(g)H2(g)+CO2(g)

图中L表示(填“温度”或“压强”)。其另外一个物理量X1X2(填“>”或“<”)。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从表中数据可以推断,此反应的正反应为(填“吸热”或“放热”)反应。
②500℃时,向恒容密闭容器中充入CO(g)和H2O(g)各3mol,达到平衡后CO(g)的转化率为;若该反应在绝热容器(与外界环境没有热交换)中进行,达到平衡后CO(g)的转化率将(填“增大”、“减小”或“不变”)。
③在830℃时,向恒容密闭容器中充入2molCO(g),5molH2O(g),4molH2(g)和3molCO2(g),此时v正v逆(填“>”、“<”或“=”)。
某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验装置如图所示。
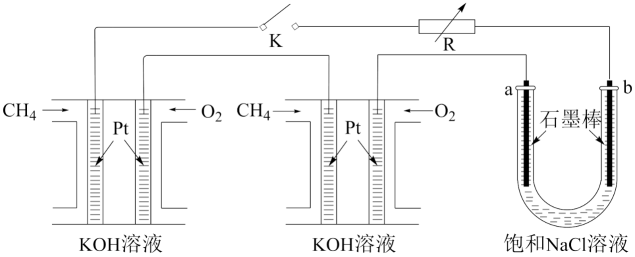
①甲烷燃料电池工作时,负极上通入的气体为(填化学式);闭合开关K后a、b电极上均有气体产生,其中a电极上得到的气体为(填化学式)。
②若每个电池甲烷通入量均为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为L(标准状况)。
为探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响,设计如图实验。
编号 | 甲 | 乙 |
实验 |
|
|
现象 | 电流计发生较小偏转,3min时无明显现象 | 电流计发生明显偏转,30s时,左边烧杯石墨电极上产生气体;右边烧杯石墨电极上产生白色沉淀(经检验为CuCl) |
①实验乙中右边烧杯电极的反应式为。
②已知E为电池电动势【又称理论电压,为两个电极电位之差,即E=E(+)-E(-)】,根据实验可知,甲电池与乙电池相比较,E甲E乙(填“>”、“<”或“=”)。
③从氧化还原反应的角度分析,Cl-对反应的影响为(填选项字母)。
A.增强了Cu2+的氧化性 B.减弱了Cu2+氧化性
C.增强了HSO的还原性 D.减弱了HSO
的还原性