 B .
B .  C .
C .  D .
D . 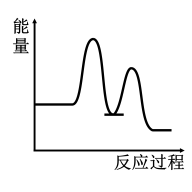

 广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法错误的是( )
广泛用于农药、橡胶、塑料等工业合成,是一种重要的有机化工原料。其相关键能和能量循环图如下所示,下列说法错误的是( )
共价键 | 键能/(kJ/mol) |
H-H | 436 |
H-I | 299 |
I-I | 151 |
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(HI)/mol | 0 | 0.18 | 0.35 | 0.50 | 0.62 |
则2~6 min内,以H2的物质的量浓度变化表示的反应速率为( )

弱酸 | HCOOH | HClO | ||
电离平衡常数(25℃) |

反应I:(COOCH3)2(g)+2H2(g)CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应II:(COOCH3)2(g)+4H2(g)HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性[×100%]与温度的关系如图所示。下列说法正确的是( )

反应ⅰ:
反应ⅱ:
在催化加氢制取甲醇的反应体系中,两个反应同时进行,则下列说法错误的是( )
探究不同条件下空气中氧气氧化KI的速率。
组别 | 温度 | KI溶液 | H2SO4溶液 | 蒸馏水 | 淀粉溶液 | ||
c(KI) | V | c(H2SO4) | V | ||||
1 | 298 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
2 | 313 K | 0.1 mol/L | 5 mL | 0.1 mol/L | 5 mL | 10 mL | 3滴 |
3 | 298 K | 0.1 mol/L | 10 mL | 0.1 mol/L | 5 mL | 5 mL | 3滴 |
①酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
②设计实验组别3的目的是。
试剂:0.01 mol/LKI溶液,0.005 mol/LFe2(SO4)3溶液,淀粉溶液,0.01 mol/LAgNO3溶液,KSCN溶液。实验如图:

①甲同学通过试管ⅰ和试管ⅱ中现象结合可证明该反应为可逆反应,则试管ⅰ中现象为:;乙同学认为该现象无法证明该反应为可逆反应,原因为:。
②请选择上述试剂重新设计实验,证明该反应为可逆反应:。
NaH2PO2属于(填“正盐”“酸式盐”或“无法确定”)。
提出假设。稀释HAc溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验。用浓度均为0.1mol/L的HAc和NaAc溶液,按下表配制总体积相同的系列溶液:测定pH,记录数据如下。
【表1】
序号 | pH | ||||
Ⅰ | 40.00 | / | / | 0 | 2.86 |
Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
… | |||||
Ⅶ | 4.00 | a | b | 4.53 | |
Ⅷ | 4.00 | 4.00 | 32.00 | 4.65 |
①根据表中信息,补充数据:a=,b=。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡(填“正”或“逆”)向移动:结合表中数据,给出判断理由:。
③由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡逆向移动。
实验结论假设成立。
①应选用作指示剂,判断到达滴定终点的实验现象是。
②下列操作会导致实验结果偏低的是。(填标号)
A.碱式滴定管未用标准NaOH溶液润洗
B.盛装未知液的锥形瓶用蒸馏水洗后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.滴定过程中振荡锥形瓶,液体不慎溅出
③某学生进行3次实验得到相关数据如下所示。
【表2】
滴定次数 | 待测HAc的体积/mL | 消耗0.1000mol/LNaOH溶液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.00 | 28.13 |
第二次 | 25.00 | 1.56 | 32.30 |
第三次 | 25.00 | 0.22 | 28.29 |
则HAc的物质的量浓度为mol/L(保留四位小数)。
查阅资料获悉:一定条件下,按配制的溶液中,
的值等于HAc的
。
如果只有浓度均约为0.1mol/L的HAc和NaOH溶液,如何准确测定HAc的?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ | 移取20.00mLHAc溶液,用NaOH溶液滴定至终点,消耗NaOH溶液 |
Ⅱ | ,测得溶液的pH为4.76 |
实验总结得到的结果与资料数据相符,方案可行。
第一步(快速平衡)
第二步(慢反应)
①用表示的速率方程为:
;
表示的速率方程为:
,
与
分别表示速率常数(只与温度有关),则
。
②下列关于反应的说法正确的是(填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.升高温度,正反应速率减小,逆反应速率增大
D.反应达到平衡时,

①请写出内,甲容器中
的反应速率增大的原因:。
②甲达平衡时,温度若为 , 此温度下的平衡常数K=。
③平衡时, ,
(填“>”“<”或“=”)。
主反应:
副反应:

将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图,试分析脱硝的适宜温度是(填序号)。
a. b.
c.

该反应历程中,使用催化剂条件下的决速步骤的反应方程式为:。

①Y点对应的温度和压强为℃、kPa。
②M点时容器中为
, CO为
, 反应①的压强平衡常数
(压强平衡常数
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
③图中M点的高于N点的原因是。