
选项 | 已知条件 | 热化学方程式 |
A | H2的燃烧热为akJ•mol-1 | H2(g)+Cl2(g)=2HCl(g) △H=akJ•mol-1 |
B | 1molCH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量 | CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ |
C | 12g石墨比12g金刚石能量少bkJ | C(石墨,s)=C(金刚石,s) △H=bkJ•mol-1 |
D | 2molAB分解生成A2和B2气体,吸收热量ckJ | 2AB=A2+B2 △H=ckJ•mol-1 |


选项 | 实验目的 | 实验方法或操作 |
A | 测定中和反应反应热 | 酸碱中和的同时,用铜质环形搅拌棒搅拌 |
B | 判断反应后Ag+是否沉淀完全 | 将AgNO3溶液与NaCl溶液混合,反应后静置,向上层清液中再加入1滴NaCl溶液 |
C | 探究压强对化学反应平衡移动的影响 | 容器中反应H2(g)+Br2(g)=2HBr(g)达平衡时,将容器压缩为原体积的 |
D | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的盐酸,分别加入等体积、等浓度的NaOH溶液,对比现象 |


实验编号 | 1 | 2 | 3 | 4 |
10% H2O2的体积/mL | 10.0 | 10.0 | 10.0 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | 1.5 |
水的体积/mL | 15.0 | 14.5 | V1 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸性条件下:MnO2+H2O2+2H+=Mn2++O2↑+2H2O。
①表中V1=mL,V2=mL。
②实验测得t2>t3>t4 , 则可得出的实验结论是。
①温度升高,k逆(填“增大”“减小”或“不变”)。
②该温度下该反应的平衡常数为(用k正、k逆表示)。
ⅰ.CO(g)+2H2(g)CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH=-c kJ/mol。
回答下列问题:
①下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
②该反应达到平衡时,其他条件不变,通入CO2时,则v(正)(填“>”“<”或“=”)v(逆),平衡常数(填“变大”“变小”或“不变”)。
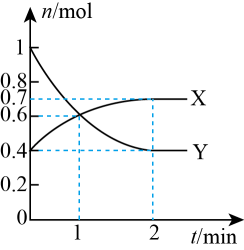
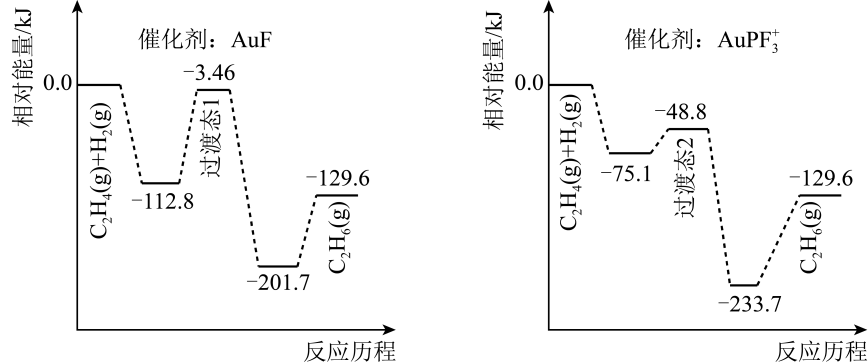
①Y为(填化学式)。
②0~1min时v(CO)为mol/(L·min)。
③该温度下,该反应的平衡常数Kc=。



化学键 | C-H | H-H | H-O |
键能/ kJ/mol | 414 | 436 | 467 |
①C≡O(CO)的键能为(用含a的式子表示) kJ/mol。
②当体系温度等于T K时ΔH−TΔS=0,温度大于T时ΔH−TΔS(填“>”“<”或“=”)0。

①X表示(填“温度”或“压强”),该反应的平衡常数表达式Kc=。
②m、n、q点的平衡常数由大到小的顺序为。
③若q点对应的纵坐标为30,此时甲烷的转化率为,该条件下平衡常数Kc=(保留两位有效数字)。