 B .
B . 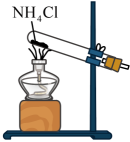 C .
C .  D .
D . 




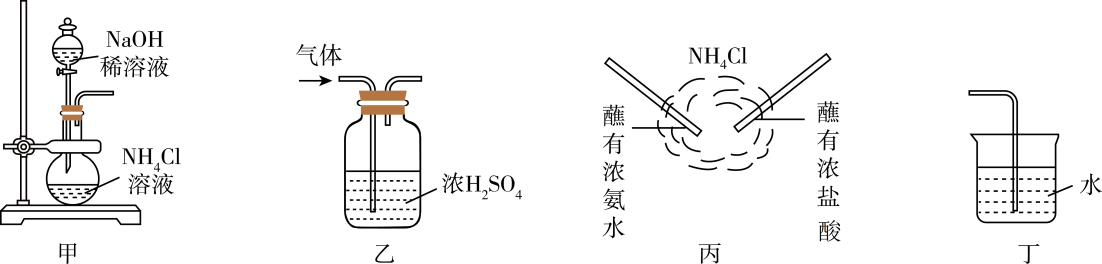

实验步骤如下:
①按照如图装置连接好仪器,关闭所有止水夹。检查装置的气密性。
②在装置A中的烧杯中加入30%的氢氧化钠溶液。在装置C的U型管中加入4.0mol·L-1的硝酸,排除U型管左端管内空气。
③塞紧连接铜丝的胶塞,打开止水夹K1 , 反应进行一段时间。
④进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色。气体进入烧杯中与氢氧化钠溶液反应。
回答下列问题:
①和
反应的离子方程式为。
②吸收器内装填碎瓷片填料的目的是(填字母)。
A.增大氮氧化物的吸收速率 B.防止氮氧化物气体外逸

①当小于7时,
吸收率随
增大而减小的原因是。
②当大于7时,
吸收率随
增大而增大的原因是。

①用装置A制备NH3 , 其中发生反应的化学方程式为;装置B内的试剂是。
②装置D中发生反应的离子方程式是,铜丝可抽动的优点是。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为。
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:

(α表示NOx中NO2的含量):
用NaOH溶液吸收氮氧化物的最佳条件为:α=,c(NaOH)=。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为。