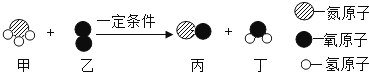
 B .
B .  C .
C .  D .
D . 
| 选项 | 实验目的 | 实验操作 |
| A | 分离硫酸钠和硫酸铜的混合溶液 | 加入过量的氢氧化钠溶液后过滤,并将滤渣溶于稀硫酸 |
| B | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞试液 |
| C | 不损坏铁制品的前提下除去表面铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 比较Fe、Cu、Ag的金属活动性强弱 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |

 B . 稀释浓硫酸
B . 稀释浓硫酸 C . 倾倒液体
C . 倾倒液体 D . 点燃酒精灯
D . 点燃酒精灯



| 物质 | 除杂试剂(足量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入足量氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | KCl(KClO3) | MnO2 | 加入MnO2后加热 |
| D | NaCl(Na2CO3) | 盐酸 | 加入过量盐酸、蒸发、结晶 |
①滤液中一定有Zn2+、Fe2+;②滤液中可能有Ag+;③滤渣中一定Ag,有可能有Fe。


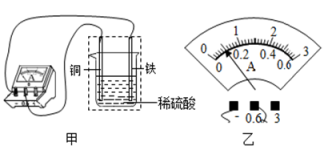


【查阅资料】钠常温下就能与水发生剧烈反应,反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表中所示。
|
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
|
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
|
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
|
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
|
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】
【实验反思】实验中生成氢氧化铜沉淀的原理是(用化学方程式表示)。




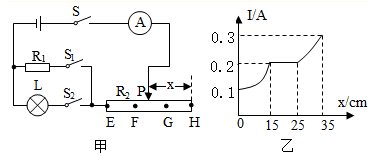
①闭合开关S、S1 , 断开开关S2 , 移动滑片,使电流表示数为A;
②闭合开关S、S2 , 断开开关S1 , 保持滑片位置不变,读出电流表示数为I;
③该灯泡的额定功率为(用测量值和已知量表示)。





| 实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入稀盐酸的质量(g) | 25 | 25 | 25 | 25 | 25 | 25 |
| 电子天平的示数(g) | 125 | 150 | 175 | 199.7 | M | 248.9 |