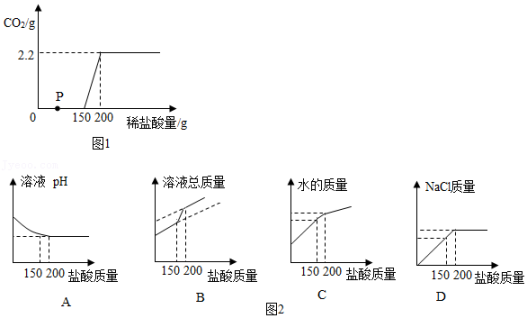
读取液体的体积
B .
读取液体的体积
B .  过滤
C .
过滤
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  点燃酒精灯
点燃酒精灯
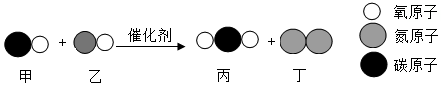
| 选项 | 实验目的 | 实验方案 |
| A | 除去CO2中的HCl气体 | 通过盛有NaOH溶液的洗气瓶 |
| B | 鉴别氮气和氧气 | 将带火星的木条分别伸入集气瓶 |
| C | 鉴别NaOH和NH4NO3固体 | 分别溶于水,测溶解前后液体温度变化 |
| D | 从KCl与MnO2的混合物中回收MnO2 | 加水溶解、过滤、洗涤、干燥 |



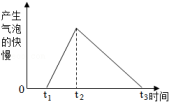
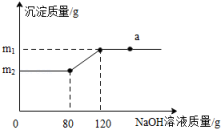
①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
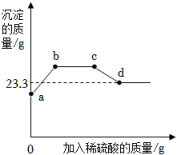
①若反应后烧杯中有固体存在,则原黑色粉末中一定含有碳粉②黑色固体粉末可能由铁粉和碳粉组成③黑色固体中一定有铁,且其质量不低于11.2g④反应后可能得到红色固体⑤该稀硫酸的溶 质的质量分数为19.6%

①可用于医疗急救的是;②可用来裁玻璃的是;③可用作钾肥的是。




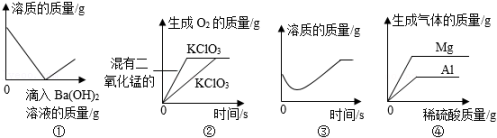
①H2 ②O2 ③CO2
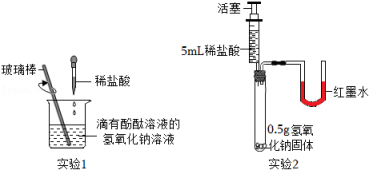
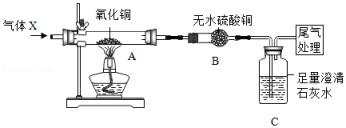
小乐为了探究反应所得红色固体的成分,进行了如下实验:
|
实验操作 |
实验现象 |
实验结论 |
|
|
步骤一 |
取20g红色固体于烧杯中,加入足量稀硫酸 |
|
红色固体可能是氧化亚铜,也可能是铜和氧化亚铜 |
|
步骤二 |
将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 |
剩余红色固体质量为12g |
20g红色固体中,铜和氧化亚铜的质量比为 |
久置的氢氧化钠固体的成分有下面3种可能情况:
猜想一:只有氢氧化钠
猜想二:
猜想三:只有碳酸钠
|
实验方案 |
实验现象 |
结论 |
|
称取m克固体放入试管中,加蒸馏水完全溶解,然后滴加足量的BaCl2溶液 |
|
猜想一不成立 |
为了进一步验证是猜想二还是猜想三成立,活动小组的同学们又提出了一个定量实验方案。实验如下:将反应后的物质过滤、洗涤、干燥,称得沉淀的质量为ng(忽略操作过程中物质的损失)。若猜想二成立,则n的取值范围是 。
氢氧化钠暴露在空气中容易变质,其主要原因是 (用化学方程式表示),因此实验室中氢氧化钠固体必须密封保存。
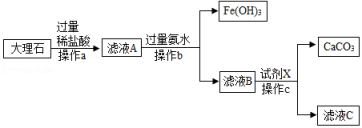

不同的小组采用了不同的方法,但是他们都成功的测定了所取样品中碳酸钙的质量分数。
【第一组】
⑴称取12g样品放入烧杯;
⑵加入足量的稀盐酸至不再产生气体时,过滤、洗涤、干燥后称量剩余固体质量为3.6g;
⑶根据剩余固体的质量求出样品中碳酸钙的质量分数为。
【第二组】
⑴称取6g样品:按规范操作,用托盘天平称取6g样品时,若指针略向左偏转,要使指针居中的恰当操作是:;把称取好的样品放入烧杯中(烧杯质量为10g)。
⑵将50g稀盐酸分5次加入,每次加入稀盐酸后,用玻璃棒不断搅拌,然后对烧杯(包括溶液和残余固体)进行了称量,记录如下表:
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
|
加入稀盐酸的总质量(g) |
10 |
20 |
30 |
40 |
50 |
|
烧杯和药品总质量(g) |
25.56 |
35.12 |
44.68 |
54.24 |
64.24 |
⑶分析数据,进行计算。
①样品完全反应后生成二氧化碳的质量为 g.
②石灰石样品中碳酸钙的质量分数是多少?(计算结果精确到0.1%)
③最后所得溶液的质量为g.
|
第一次 |
第二次 |
第三次 |
第四次 |
|
|
加入稀硫酸的质量/g |
20 |
20 |
20 |
20 |
|
产生氢气的质量/g |
0.05 |
0.15 |
0.20 |
m |