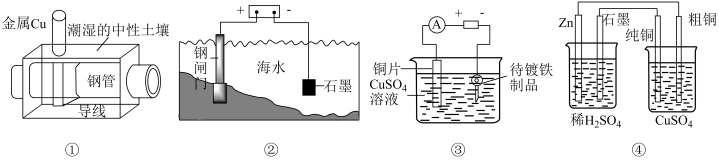


下列有关说法正确的是( )

已知:Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:Ce3+(水层)+3HA(有机层)Ce(A)3(有机层) +3H+(水层)。下列有关说法错误的是( )
选项 | 实验操作 | 现象 | 结论 |
A | A、B两支试管中分别加入10mL5%的H2O2溶液,在A试管中加入1mLFeCl3溶液,在B试管中加入1mL蒸馏水 | A试管中产生气泡更快 | FeCl3是H2O2分解的催化剂 |
B | 室温下,向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀,再滴加2滴0.1mol/LFeCl3溶液 | 有红褐色沉淀生成 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 将5mL0.1mol/LFeCl3溶液与2mL0.1mol/LKI溶液混合于试管中充分反应后,滴加几滴KSCN溶液,振荡 | 溶液变为 血红色 | Fe3+与I-的反应有一定的限度 |
D | 向NaCl、NaI的混合溶液中滴入少量稀AgNO3溶液 | 有黄色沉淀 生成 | Ksp(AgCl)>Ksp(AgI) |
①测定0.1000mol•L-1Na2C2O4溶液pH=8.4;
②向5mL0.1000mol•L-1NaF溶液中,滴加5滴0.1000mol•L-1H2C2O4溶液;
③向0.1000mol•L-1H2C2O4溶液中滴加NaOH溶液至溶液pH=3;
④向0.1000mol•L-1Na2C2O4溶液中滴加同浓度同体积的稀盐酸。
下列说法错误的是( )
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 | HClO |
电离常数 | Ka1=5.9×10-2 Ka2=6.4×10-5 | K=1.7×10-5 | K=6.2×10-10 | Ka1=4.5×10-7 Ka2=4.8×10-11 | K=2.9×10-8 |
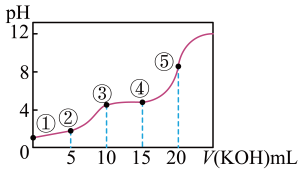
①当V<10mL时,反应的离子方程式为。
②当V=10mL时,所得溶液中各离子浓度的由大到小依次为。
③当V=20mL时,所得溶液中c(K+)=。(填物料守恒式)
④如图5点所示溶液中,水的电离程度最大的是(填序号)。
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应:2NH+Ca2++2OH-+SO
=CaSO3↓+2NH3•H2O
已知:25℃时,Kb(NH3•H2O)=a;Ksp(CaSO3)=b,该温度下,步骤2中反应的平衡常数K=(用含a、b的代数式表示)。
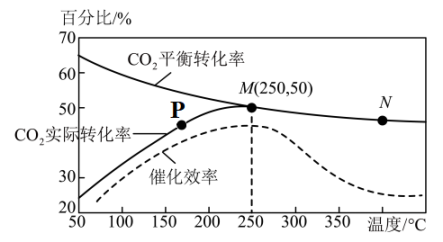
已知:①2CO(g)+SO2(g) S(l)+2CO2(g)△H1=-37.0kJ•mol-1
②2H2(g)+SO2(g) S(l)+2H2O(g)△H2=+45.4kJ•mol-1
写出CO(g)与H2O(g)反应生成CO2(g)、H2(g)的热化学方程式:。若该反应在恒温、恒容体系中进行,达到平衡的标志为(填选项字母)。
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的密度保持不变
C.混合气体的总压强保持不变
D.H2O(g)与H2(g)的体积比保持不变
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
A.CuO B.Mg(OH)2 C.Cu2(OH)2CO3 D.NH3•H2O
(已知:I2+2S2O=S4O
+2I-)。
①CuCl2溶液与KI反应的离子方程式为。
②滴定终点的现象是。
③该试样中CuCl2•2H2O的质量分数为(写出计算过程)。
CrOCr2O
Cr3+
Cr(OH)3
其中第I步存在平衡:2CrO(黄色)+2H+
Cr2O
(橙色)+H2O
①根据2CrO+2H+
Cr2O
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。图中右侧电极连接电源的极,其电极反应式为。

②第II步反应的离子方程式:。
①硫酸盐还原菌能将水中的SO转化为S2- , S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
反应的离子方程式:。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(VI)的去除率低的原因是。
①废水中SO转化为硫化物而除去,该硫化物的化学式为。
②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15min后溶液pH缓慢下降的原因可能是。
