
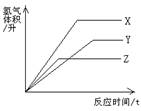
①三种金属与稀硫酸反应,X最剧烈
②反应结束消耗硫酸的质量一定相等
③三种金属的相对原子质量:X>Y>Z
④在同温同压下,产生氢气体积:最大是X
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~5 | 6~7 | 8~10 | 11~14 |
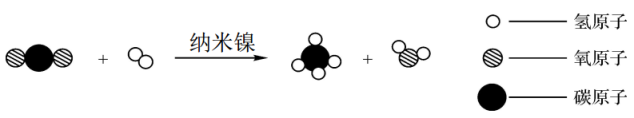
 B .
B .  C .
C .  D .
D . 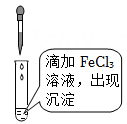
 B . 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
B . 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应  C . 等体积,等浓度的双氧水制取氧气
C . 等体积,等浓度的双氧水制取氧气  D . 服用胃舒平[主要成分 Al(OH)3]治疗胃酸过多,胃液 pH 的变化
D . 服用胃舒平[主要成分 Al(OH)3]治疗胃酸过多,胃液 pH 的变化 


①若0<b<a,滤液中一定没有Fe(NO3)2
②若b=a,滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2 , 可能有Cu(NO3)2
③若b>a,向滤渣中加稀盐酸,不可能有气泡产生
④若b>a,且忽略过滤操作中溶液损失,滤液中溶质的质量一定<原混合溶液溶质的质量
请选择以上合适的物质,将其化学式填在下面相应的空格上。

|
阴离子 阳离子 |
OH- |
NO3- |
Cl- |
SO42- |
CO32- |
|
H+ |
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
|
|
Na+ |
溶 |
溶 |
溶 |
溶 |
溶 |
|
Ca2+ |
微 |
溶 |
溶 |
微 |
不 |
|
Ba2+ |
溶 |
溶 |
溶 |
不 |
不 |
|
Cu2+ |
不 |
溶 |
溶 |
溶 |
不 |


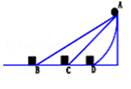
中,小徐对实心球有做功的是


Ⅰ.取样于烧杯中,加足量水充分溶解,过滤得到白色沉淀物A和滤液;
Ⅱ.往滤液中加入过量的呈中性的氯化钡溶液,发现有白色沉淀B生成。待浊液澄清后,往上层清液中滴加酚酞试液,发现溶液呈无色;
Ⅲ.取白色沉淀B,加入足量稀硝酸,发现有无色气体产生且沉淀全部消失。
请回答下列问题:
向右运动直至停止。

【查阅资料】①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是(用化学方程式表示)
②K2CO3溶液呈碱性,CaCl2溶液,KCl溶液呈中性。
【猜想假设】假设I:只含KOH;假设II:含KOH和K2CO3;假设III:只含K2CO3。
【进行实验】
|
实验操作步骤 |
实验现象 |
实验结论 |
|
a.取少量样品于试管中,加入足量的稀盐酸 |
有气泡产生 |
假设 错误 |
|
b.另取少量样品于试管中,加水溶解,加入过量的CaCl2 溶液,振荡,静置 |
产生白色沉淀 |
猜想 II 正确 |
|
c.取②中上层清液,滴加无色的酚酞试液 |
|
【拓展应用】完全变质的 KOH 也有利用价值,从K2CO3的组成或性质看,K2CO3在农业上的用 途是 (填一种即可)。

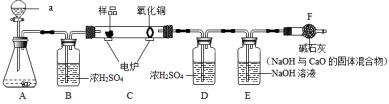
机物样品中所含的元素为。
(查阅资料)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2OCO2↑+CO↑+4H2O
碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。为了测定铁红中铁的质量
分数,小组同学进行如下实验。(装置气密性良好,尾气处理装置未画出。)

a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
|
加入稀硫酸的质量 (g) |
充分反应后剩余固体的质量 (g) |
|
|
第 1 次 |
40 |
m |
|
第 2 次 |
40 |
14.8 |
|
第 3 次 |
40 |
12.2 |
|
第 4 次 |
40 |
11.2 |
|
第 5 次 |
40 |
11.2 |
试回答下列问题:
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/克 |
5 |
10 |
15 |
20 |
|
生成 CO2 的质量/克 |
1.76 |
3.52 |
4.4 |
M |
分别取4.2克MgO、Mg(OH)2、MgCO3和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡。请结合实验现象和数据回答问题。
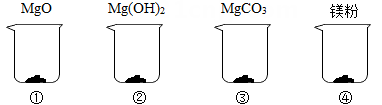
|
物质 |
MgO |
Mg(OH)2 |
MgCO3 |
“镁粉” |
|
消耗稀盐酸的质量/克 |
121.8 |
m |
58.0 |
61.9 |
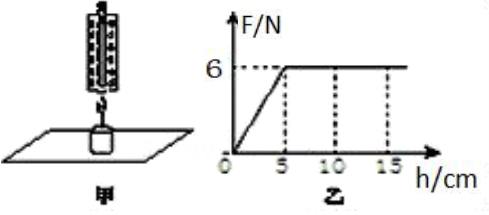
①其他条件相同时,反应物接触面积越大,反应物的浓度越高,反应速度越快;
②反应速率越快,相同时间内生成物的质量越大。请根据上述资料和所学知识解释0-t4各时间段内氢气的质量变化情况。
