化学键 | H-H | F-F | H-F | H-Cl | H-I |
E/(kJ•mol-1) | 436 | 157 | 568 | 431 | 299 |
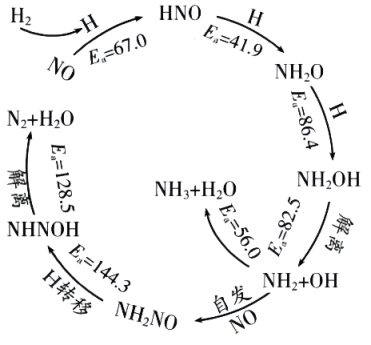
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1ΔH2(填“>”“<”或“=”)。
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是____(填字母)。
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |
则表中a=。
和
反应生成
、
和
并放出大量热,写出该反应的热化学方程式(
用含
、
、
的代数式表示)。该反应(填“是”或“不是”)自发反应,判断的理由是。
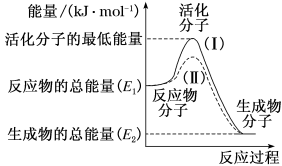
①D点v(正)v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是点。 时,N2O4的平衡转化率为;若达平衡时间为5 s,则此时间内的
平均反应速率为。
③若其条件不变,在原平衡基础上,再加入一定量
, 达到新平衡时,与原平衡相比,NO2的体积分数(填“增大”“不变”或“减小”)。
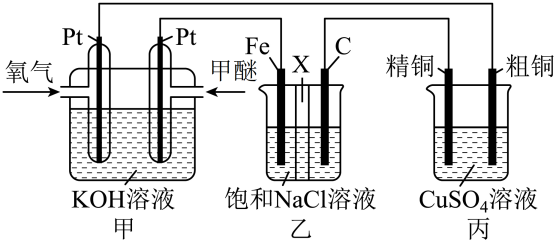
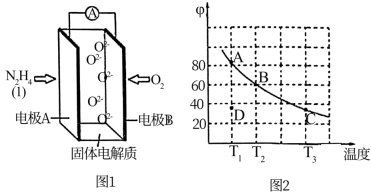
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2 , 含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
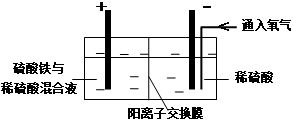
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是。(使用化学用语作答)
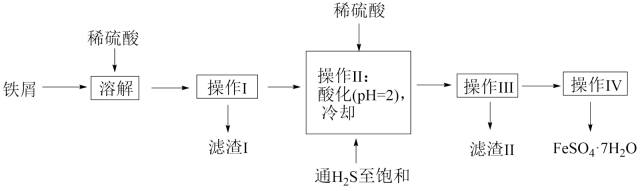
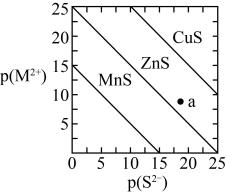
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的如表:
1.5 | 6.5 | 7.7 |
3.7 | 9.7 | 9.2 |
回答下列问题: