
CH3CH2CH2·+HBrCH3CH2CH2+Br·
·CH(CH3)2+HBr
下列说法正确的是: ( )

则总反应![]() CH4 (g)+H2O(g)=
CH4 (g)+H2O(g)=![]() CO2 (g)+2H2 (g) 的 ΔH 等于 ( )
CO2 (g)+2H2 (g) 的 ΔH 等于 ( )

完成下列填空:
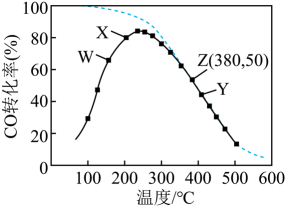
C3H8的转化率随温度升高而上升的原因是,写出一条提高C3H6产率的措施。
已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。


a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
已知:K300℃>K350℃ , 则该反应是热反应。

a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
a.准时分别出NO2气体 b.适当上升温度 c.增大O2的浓度 d.选择高效催化剂

从循环结果看,能量转化的主要方式是。
请写出表示二甲醚燃烧热的热化学方程式。
二甲醚水解: 活化能
甲醇与水蒸气重整: 活化能
已知远小于
。在恒温恒容容器内,二甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(
)浓度随时间变化的曲线图。


①用量筒量取硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
实验过程中用到只量筒,只温度计,测定一组数据需要测定次温度。
向的NaOH溶液中加入下列物质:①稀醋酸,②稀盐酸,③浓硫酸,恰好完全反应时对应的热效应
、
、
的关系正确的是
A. B.
C. D.

a、b、c三点的电离程度大小关系:。