
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | NaBr(aq)(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | NH4Cl(aq)(FeCl3) | NaOH(aq) | 过滤 |
| C | CO2(CO) | CuO粉末 | 通过灼热的CuO粉末 |
| D | CH3COOC2H5(CH3COOH) | C2H5OH、浓硫酸 | 加热蒸馏 |
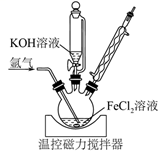
3MnO42-+2H2O=2MnO4-+MnO2↓+4OH- , 下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )
|
|
|
|
|
| A.制取Cl2 | B.净化Cl2 | C.使K2MnO4→KMnO4 | D.分离MnO2 |



①向X中加入少量氯水,再滴加淀粉溶液,未显蓝色;
②另取100 mL X加入过量氯水,再滴加足量BaCl2(aq),得到沉淀6.99 g;
③将②反应后的混合液过滤,在滤液中加足量NaOH(aq)加热,生成0.01 mol气体。
根据上述实验,原溶液中( )

| 试剂 | 现象 | |
| 1 | 酚酞 | 溶液变红,加水稀释,红色变浅 |
| 2 | 少量SO2 | 用pH试纸测得溶液pH≈8 |
| 3 | 少量Cl2 | 无明显现象 |
下列说法错误的是( )
完成下列填空:
 中的含氧官能团是,写出满足以下条件的该原料的一种同分异构体的结构简式。
中的含氧官能团是,写出满足以下条件的该原料的一种同分异构体的结构简式。
(i)是含有三个六元碳环的芳香族化合物;
(ii)只有一种含氧官能团;
(iii)分子中有4种不同化学环境的氢。

称取1.023 g NaBO3·4H2O(M=153.86 g·mol-1)加入20.0 mL 1 mol·L-1 H2SO4(aq)酸化后定容至100 mL,取出10.00 mL用0.01046 mol·L-1 的KMnO4(aq)滴定至终点,消耗KMnO4(aq) 24.34 mL。
已知:① BO3-+2H2O=H2O2+H2BO3-
② MnO4-+H2O2+H+→Mn2++O2↑+H2O(未配平)
2MnO4-+5H2O2+_H+=_Mn2++_O2↑+_H2O

完成下列填空:
C3H8的转化率随温度升高而上升的原因是,写出一条提高C3H6产率的措施。
已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。


a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度