

| 实验室制取氨气 | 检验产物乙炔 | 检验浓硫酸与铜反应产生的二氧化硫 | 证明溶解度:AgCl>AgI |
|
|
|
|
|
| A | B | C | D |
| 容器1 | 容器2 | 容器3 | |
| 反应温度(℃) | 400 | 400 | 500 |
| 起始量 | 1mol | 2mol HI | 1mol |
| 平衡浓度 | | | |
| 平衡转化率 | | | |
| 平衡常数 | | | |
下列各项关系错误的是( )


| 装置 | 序号 | 电解质溶液 | 实验现象(电解后) |
|
| I |
| 溶液仍呈蓝色,附着的铜层无明显变化 |
| II | 稀 | 溶液由蓝色开始变为浅黄绿色,2min后溶液变浑浊 | |
| III | 浓 | 溶液由绿色逐渐变为深黄绿色(略黑),附着的铜层变薄 |
已知:①②
(无色)③
;黄色
下列分析错误的是( )

已知:阿伏加德罗常数为 ,
, 硒化锌的摩尔质量为
, 该晶胞密度为
, 计算该晶胞的边长为
。(列出计算式)
已知:a.
b.
c.
计算。

甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是。
②210-270℃间,催化剂2条件下的转化率随温度的升高而增大,可能原因为。
下列能说明反应达到化学平衡状态的是(填字母)。
a.相同时间内,键断裂,同时有
键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| | 1.6 | l.0 | 0.8 | 0.8 | 0.8 |
的平衡转化率为;t℃时,该反应的平衡常数K=。

放电时,正极上的电极反应为;若电池工作时产生a库仑的电量,则理论上消耗锌的质量为g。(已知:转移1mol电子所产生的电量为96500库仑)
a.F和G互为同分异构体
b.G在空气中能稳定存在
c.F和G可以利用溶液进行鉴别
d.1molF与足量NaOH溶液反应,最多可消耗2molNaOH

P、Q分别为、。
①焙烧时为加快反应速率,可采取的措施是。
②生成的化学方程式如下,将其补充完整:。
□+□
□_+□
+□

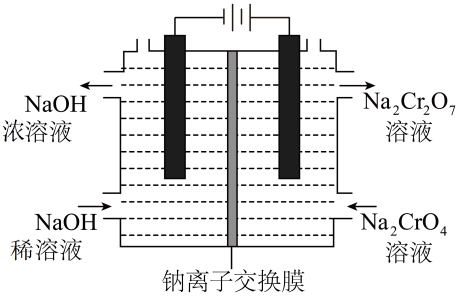
①结晶时,将混合溶液加热浓缩、(填操作)、冷却结晶、过滤得到红矾钠晶体。
②滤液5最适宜返回上述流程中,参与循环再利用。
①甲同学认为溶液变红的原因是通入SO2后,Fe3+水解程度增大,形成Fe(OH)3胶体。乙同学根据SO2的性质否定了这一推论,原因是。
②丙同学取上述5min后的黄色溶液,滴加盐酸酸化的BaCl2溶液,产生白色沉淀。该同学认为SO2与Fe3+发生氧化还原反应。丁同学认为该结论不严谨,重新设计并进行实验,证明两者发生了氧化还原反应,写出实验方案及现象。
该小组同学分析SO2水溶液成分,猜想可能是其中含S(IV)微粒SO2、H2SO3、与Fe3+形成配合物而使溶液呈现红色。进行如下实验:
|
序号 |
实验 |
加入试剂 |
现象 |
|
I |
| 2mL1mol/LNaHSO3溶液;再滴加几滴盐酸 | 溶液变成红色,比(3)中溶液红色深;滴加盐酸后,溶液颜色由红色变成黄色 |
| II | 2mL1mol/LNa2SO3溶液 | 溶液变成红色,比I中溶液红色深 |
①a=。
②根据实验I现象,溶液中SO2、H2SO3浓度增大,红色消失,说明红色物质可能与SO2、H2SO3无关;,红色物质可能与有关。
①SO2与FeCl3溶液的反应,可以发生配位反应、氧化还原反应。
②。