

SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
 B .
B .  C .
C .  D .
D . 


实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
 B .
B . 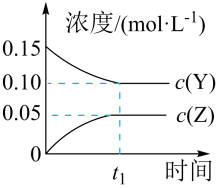 C .
C .  D .
D . 
kJ·mol
则H2(g)燃烧生成H2O(l)的热化学方程式为。
①氮原子的价电子轨道表示式为。
②元素的基态气志原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能()。第二周期部分元素的变化趋势
如图所示。氮元素的(
)呈现异常的原因是。


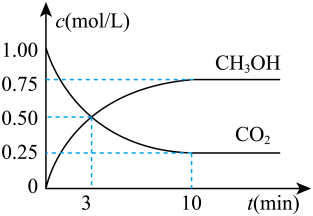
①计算3 min内用氢气表示的该反应的反应速率;3 min时,正反应速率逆反应速率(填“>”“=”或“<”)。
②10 min反应达平衡,氢气的转化率为。当反应达平衡后,维持温度和压强不变,改变其它条件使反应速率增大,采取的措施(写一条即可)

①甲烷进口为极(左图),Pt(b)电极发生反应(填“氧化”或“还原”)。
②以石墨做电极电解饱和食盐水(滴有酚酞),如图所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色。该极的电极反应式为。

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
② | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。

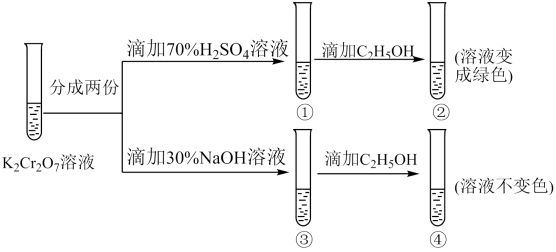
向溶液中加入30%NaOH溶液。溶液呈色:向
溶液中逐滴加入
溶液(已知
为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。